
 已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )
已知卤化银AgX的沉淀溶解平衡曲线如图所示,横坐标p(Ag+)=-lg(Ag+),纵坐标Y=-lg(X-),下列说法正确的是( )| A. | 该温度下AgCl的Ksp约为1×10-15 | |
| B. | a点可表示AgCl的过饱和溶液 | |
| C. | b点时c(Ag+)=c(I-) | |
| D. | 该温度下,AgCl和AgBr饱和溶液中:c(Cl-)<c(Br-) |
分析 A.结合图象,依据Ksp(AgCl)=c(Ag+)×c(Cl-)计算即可;
B.依据a点计算出AgCl的Qc与Ksp(AgCl)比较,若Qc>Ksp(AgCl),则此时溶液为饱和溶液;
C.b点为不饱和溶,银离子碘离子的浓度都需要饱和溶液时的浓度c(Ag+)=c(I-);
D.依据图象得出此温度下,AgCl的溶解度大于AgBr的溶解度,据此判断浓度即可.
解答 解:A.由图象可知p(Ag+)=5,Y=5时AgCl溶液达到饱和,则Ksp=1×10-10,故A错误;
B.由图象得出此温度下,饱和AgCl溶液的Ksp(AgCl)=10-10,a点p(Ag+)=-lgC(Ag+)=4,c(Ag+)=10-4:纵坐标Y=-lgC(X-)=4,c(Cl-)=10-4,故AgCl的Qc=c(Cl-)×c(Ag+)>10-8>10-10,故a点为AgCl的过饱和溶液,故B正确;
C.b点在AgBr的平衡曲线右上侧,说明p(Ag+)、Y较大,则c(Ag+)、c(X-)较小,没有达到平衡状态,为不饱和溶液,c(Ag+)=c(I-)都需要饱和溶液时的浓度,故C错误;
D.由于此温度下,Ksp(AgCl)>Ksp(AgBr),故溶液中c(Cl-)>c(Br-),故D错误;
故选B.
点评 本题主要考查难溶电解质的溶解平衡图象,充分理解图象并从图象中得出解题所需要的信息为解答关键,试题侧重考查学生的分析、理解能力,注意掌握难溶物溶解平衡及其影响、溶度积的概念及其应用方法,题目难度中等.


科目:高中化学 来源: 题型:实验题
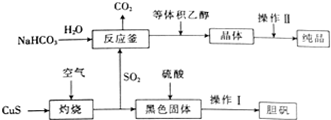 硫及其化合物在生产及生活中有着广泛的应用.
硫及其化合物在生产及生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、胆矾 | ||
| C. | HNO3、乙醇、氯化钠 | D. | H3PO4、熟石灰、苛性钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
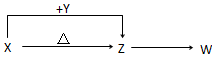 X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体.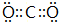 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com