
【题目】(1)标准状况下,1.204×1023个氧气分子的体积是________L;
(2)标准状况下,某气体的密度为1.25 g·L-1,则其摩尔质量为________;
(3)将4.6 g钠投入足量的水中,生成NaOH的质量为______g,生成H2的体积在标准状况下为____________。
(4)400 mL某浓度的NaOH溶液恰好与11.2 L Cl2(标准状况)完全反应,生成NaClO的物质的量为________,原NaOH溶液物质的量浓度为_________________。
(5)在标准状况下,CO和CO2的混合气体共17.92 L,质量为28.8 g。则两种气体的物质的量之和为____________mol,其中CO2为________mol。
【答案】4.48 L 28 g·mol-1 8 2.24 L 0.5 mol 2.5 mol·L-1 0.8 0.4
【解析】
(1)含 1.204×1023个氧气分子的氧气的物质的量为,![]() =0.2mol,其在标准状况下的体积是0.2mol×22.4L/mol=4.48L;
=0.2mol,其在标准状况下的体积是0.2mol×22.4L/mol=4.48L;
(2)标准状况下,某气体的密度为![]() =1.25 g·L-1,则其摩尔质量M=1.25 g·L-1×22.4L/mol=28 g·mol-1;
=1.25 g·L-1,则其摩尔质量M=1.25 g·L-1×22.4L/mol=28 g·mol-1;
(3)4.6 g钠的物质的量为![]() =0.2mol,由2Na+2H2O=2NaOH+H2↑可知生成NaOH的物质的量为0.2mol,H2的物质的量为0.1mol,则NaOH的质量为0.2mol×40g/mol=8g,H2在标准状况下的体积为0.1mol×22.4L/mol=2.24L;
=0.2mol,由2Na+2H2O=2NaOH+H2↑可知生成NaOH的物质的量为0.2mol,H2的物质的量为0.1mol,则NaOH的质量为0.2mol×40g/mol=8g,H2在标准状况下的体积为0.1mol×22.4L/mol=2.24L;
(4) 氯气和氢氧化钠反应的方程式为:
2NaOH + C12 = NaCl+NaClO+H2O
2mol 22.4L 1mol
c(NaOH)×0.4L 11.2L n(NaClO)
则:n(NaClO)=![]() =0.5mol,c(NaOH)=
=0.5mol,c(NaOH)=![]() =2.5mol/L;
=2.5mol/L;
(5) 标准状况下17.92 LCO和CO2的混合气体的物质的量之和为:![]() =0.8mol;设混合气体中CO和CO2的物质的量分别为x、y,则:28x+44y=28.8、x+y=0.8,解得:x=0.4mol、y=0.4mol,即混合气体中CO为0.4mol,二氧化碳的物质的量为0.4mol。
=0.8mol;设混合气体中CO和CO2的物质的量分别为x、y,则:28x+44y=28.8、x+y=0.8,解得:x=0.4mol、y=0.4mol,即混合气体中CO为0.4mol,二氧化碳的物质的量为0.4mol。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】下列几组物质:
①苯和乙苯②CH3COOH和![]() ③CH3CH2CH2CH3和
③CH3CH2CH2CH3和![]()
④ CH3CH2C≡CH和CH3C≡CCH3⑤CH2=CHCH2CH3和![]() ⑥
⑥![]() 和
和![]()
(1)属于同系物的是_______(填序号,下同);
(2)属于同一物质的是_______;
(3)由于碳骨架不同而产生的同分异构体是_______ ;
(4)由于官能团的位置不同而产生的同分异构体是_______;
(5)具有不同官能团的同分异构体是 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 除去水垢中的![]() 常用试剂有碳酸钠和盐酸
常用试剂有碳酸钠和盐酸
B. 煤干馏可以得到焦炉气、粗氨水、芳香族化合物、焦炭等物质
C. 用碘水检验淀粉是否水解完全
D. 天然纤维、合成纤维和人造纤维组成元素完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________;N原子的第一电离能比O原子的大,其原因是_________________________,基态铁原子的价电子排布图为_______
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________。

(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子__________(填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___(填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______(填最简整数比);已知该晶体的密度dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数为______nm(用含d和NA的代数式表示)。

(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是___________热反应,Ba(OH)28H2O与NH4Cl的反应是________________________热反应.反应过程___________________________(填“①”或“②”)的能量变化可用图2表示.

(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号).

(3)将CH4设计成燃料电池,其利用率更高,装置如图4所示(a、b为多孔碳棒)处电极入口通甲烷(填A或B),其电极反应式为_____________________ .

(4)如图5是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为___________________________ .
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
某化学小组根据上述反应原理进行下列实验:
Ⅰ.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol·L-1KMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在________(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会________(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为________。
(4)计算H2C2O4溶液的物质的量浓度为________mol·L-1。
Ⅱ.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1mol·L-1KMnO4溶液 | 0.1mol·L-1H2C2 O4溶液 | 0.1mol·L-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中V1=________,V2=________。
(6)实验中需要测量的数据是________。
(7)实验中________(填“能”或“不能”)用0.2mol·L-1盐酸代替0.1mol·L-1H2SO4溶液,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4![]() 2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为____。
(2)该反应的平衡常数K=___。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色___(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号)___,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)___。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。____
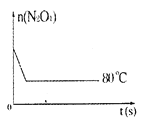
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近报道的一种处理垃圾渗滤液并用其发电的示意图如下。装置工作时,下列说法不正确的是

A. 化学能转变为电能
B. 盐桥中K+向X极移动
C. 电子由X极沿导线流向Y极
D. Y极发生的反应为2NO3-+10e-+12H+=N2+ 6H2O,周围pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO42-空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO42-互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________。
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com