
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1 kJ,又知胆矾分解的热化学方程式为:CuSO4·5H2O(s)  CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L
CuSO4(s)+5H2O(l) ΔH=+Q2 mol·L 则Q1和Q2的关系为( )
则Q1和Q2的关系为( )
| A.Q1<Q2 | B.Q1>Q2 | C.Q1=Q2 | D.无法确定 |
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:单选题
沼气是一种能源,它的主要成分是CH4。0.5molCH4完全燃烧生成CO2和液态水时放出445kJ的热量,则下列热化学方程式中正确的是
| A.2CH4(g) + 4O2(g) =2CO2(g) + 4H2O(l) ΔH=+890kJ·mol-1 |
| B.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=+890kJ·mol-1 |
| C.CH4(g) + 2O2(g) =CO2(g) + 2H2O(l) ΔH=-890kJ·mol-1 |
| D.1/2CH4(g) + O2(g) =1/2CO2(g) + H2O(l) ΔH=-890kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列变化属于吸热反应的是 ( )
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④氯酸钾分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥Ba(OH)2·8H2O与NH4Cl晶体混合
| A.①④⑤ | B.①②④ | C.①②⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
A.NH3·H2O NH4++OH-达到平衡后,升高温度平衡正向移动 NH4++OH-达到平衡后,升高温度平衡正向移动 |
| B.在海轮的外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.明矾水解生成Al(OH)3胶体,可用作净水剂 |
| D.如图所示的反应过程中A+B→X的△H<0,X→C的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于下列各图的叙述,正确的是
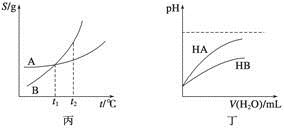
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44kJ的热量。其它相关数据如下表,则表中X为:
| | O=O(g) | H-H(g) | H-O(g) |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | X | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①101 kPa时,2C(s)+O2(g)==="2CO(g)" ΔH=-221 kJ/mol;
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol。
下列结论正确的是
| A.碳的燃烧热大于110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式或说法,正确的是( )
| A.甲烷的燃烧热为 890 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890 kJ·mol-1 |
B.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g);ΔH=-38.6 kJ·mol-1 2NH3(g);ΔH=-38.6 kJ·mol-1 |
| C.已知:H2(g)+F2(g)=2HF(g);ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com