
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L任意比的O2和N2的混合气体中含有的分子总数均为NA | |
| B. | 标准状况下,14 g氮气含有的氮原子数为0.5NA | |
| C. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| D. | 标准状况下,22.4LH2O所含有的电子数是10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化合物的结构(键线式)如图,下列关于该有机物的叙述正确的是( )
某化合物的结构(键线式)如图,下列关于该有机物的叙述正确的是( )| A. | 该有机物中含有8种类型的氢原子 | |
| B. | 1mol该有机物完全燃烧可以产生6mol水 | |
| C. | 该有机物属于芳香族化合物 | |
| D. | 该有机物一定条件下可以发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
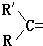 变成
变成 .现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )
.现有某烯烃A,分子式为C4H8,被酸性高锰酸钾溶液氧化后不可能得到的产物是( )| A. | CH3COOH | B. | CO2和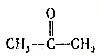 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04mol•L-1•s-1 | B. | 0.005mol•L-1•s-1 | ||
| C. | 0.01mol•L-1•s-1 | D. | 0.1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
,写出更改试剂(气体过量)后生成沉淀E所发生反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com