
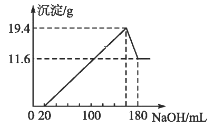
【题目】将一定质量的镁铝粉末混合物投入一定浓度的200 mL盐酸中,使合金全部溶解,向所得溶液中滴加5.0 mol·L-1的NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液的体积的关系如图所示。
(1)原合金中铝的物质的量分数为_____________。
(2)盐酸中HCl的物质的量浓度为_____________。
【答案】36% 4mol/L
【解析】
由图可知,加入20m氢氧化钠溶液开始产生沉淀,说明所得溶液中含有盐酸;再加入氢氧化钠溶液,镁离子和铝离子完全反应生成19.4g沉淀,当加入180ml氢氧化钠溶液时,氢氧化铝与氢氧化钠溶液完全反应,得到11.6g氢氧化镁沉淀。
(1)由图可知,氢氧化镁的质量为11.6g,氢氧化铝的质量为(19.4—11.6)g=7.8g,由原子个数守恒可知,合金中镁的质量为![]() ×24g/mol=4.8g,铝的质量为
×24g/mol=4.8g,铝的质量为![]() ×27g/mol=2.7g,则铝的物质的量分数为
×27g/mol=2.7g,则铝的物质的量分数为![]() ×100%=36%,故答案为:36%;
×100%=36%,故答案为:36%;
(2)由图可知,当加入180ml氢氧化钠溶液时,氢氧化铝与氢氧化钠溶液完全反应,得到氯化钠和偏铝酸钠的混合溶液,由铝原子个数守恒可知n(AlO2-)=n(Al3+)=0.1mol,由电荷守恒可得n(Na+)=n(Cl-)+n(AlO2-),n(Cl-)=5.0 mol·L-1×0.18L—0.1mol=0.8mol,则200 mL盐酸的浓度为![]() =4mol/L,故答案为:4mol/L。
=4mol/L,故答案为:4mol/L。


科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)已知反应:Fe2O3+2Al![]() Al2O3+2Fe,则
Al2O3+2Fe,则
①该反应所属基本反应类型是___。
②在反应中铁元素的化合价变化__(填“升高”或“降低”),该元素的原子__(填“失去”或“得到”)电子。
③发生氧化反应的是__,发生还原反应的是__。
(2)反应2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O中:
①反应中被氧化的元素是__,被还原的元素是___。
②若生成71gCl2,则消耗的HCl是__g,被氧化的HCl是__g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据中国之声《全国新闻联播》报道,中科院今天(2019年1月13日)通报,我国纳米技术已在动力锂电池、绿色印刷、纳米催化、健康诊疗及饮用水处理等产业领域取得重要成果。我国储氢纳米碳管研究亦获重大进展,用电弧法合成储氢纳米碳管,其原理是阳极石墨电极在电弧产生的高温下蒸发,在阴极沉积出纳米管。

此法常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化法提纯。其反应式为3C+2K2Cr2O7+8H2SO4![]() 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)纳米材料分散到溶剂中形成的分散系是________。
(2) K2Cr2O7中Cr的化合价为________。反应中氧化剂为________,发生________反应,还原剂是________,具有________性。
(3)该反应转移的电子数为________。
(4)若反应过程中转移4.816×1023个电子,则生成标准状况下________L CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弾的工作电源。一种热激活电池的基本结钩如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb,下列有关说法正确的是( )

A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 每转0.2mol电子,论上消耗42.5gLiCl
D. 电池总反应为Ca+PbSO4+2LiCl=Pb+Li2SO4+CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是
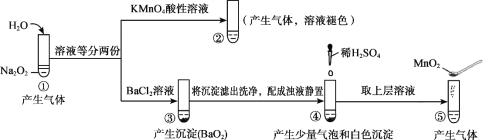
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,有刺激泩气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程是________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是________。
④用下图装置(a、b均为石墨电极)进行实验V:

i. K闭合时,指针向左偏转
ⅱ. 向右管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针向左偏转幅度增大
将i和ⅱ、ⅲ作对比,得出的结论是________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | …… |
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①9.8g H2SO4的物质的量为______mol,约含有________个H2SO4 分子
②标准状况下,22.4LH2的质量为__________ g
③将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后NaCl溶液的物质的量浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,不属于取代反应的是
A.![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.ClCH2CH===CH2+ NaOH![]() HOCH2CH===CH2+NaCl
HOCH2CH===CH2+NaCl
D.![]() +HO—NO2
+HO—NO2![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料 M 在光聚合物和金属涂料方面有重要用途,M 的结构简式为

工业上合成 M 的过程可表示如下:

已知:A 完全燃烧只生成 CO2 和 H2O,其蒸汽密度是相同状况下氢气密度的 43 倍,分子中 H、O 原子个数比为 3∶1,它与 Na 或 Na2CO3 都能反应产生无色气体。
(1)B 的结构简式是_____。
(2)A 中所含官能团的名称是_____。
(3)下列说法正确的是_____(填字母)。
a 工业上,B 主要通过石油分馏获得
b C 的同分异构体有 3 种(不包括 C)
c E→M 的反应是缩聚反应
(4)写出 A+D+H3PO4→E 反应的化学方程式:_____。
(5)F 是 A 的一种同分异构体,F 的核磁共振氢谱显示分子中有两种不同的氢原子。存在下列转化关系:
![]()
ⅰ、写出 F、N 的结构简式 F:_____;N:_____。
ⅱ、写出反应①的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com