
 A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白:
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素.请填写下列空白: NH3•H2O+H+.
NH3•H2O+H+.分析 G为主族元素的固态氧化物,电解G得到I和H,G能和氢氧化钠溶液反应生成J,工业上用电解氧化铝的方法冶炼铝,则G是Al2O3,I能和氢氧化钠溶液反应生成J,则I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,以此解答该题.
解答 解:G为主族元素的固态氧化物,电解G得到I和H,G能和氢氧化钠溶液反应生成J,工业上用电解氧化铝的方法冶炼铝,则G是Al2O3,I能和氢氧化钠溶液反应生成J,则I是Al,J是NaAlO2,H是O2,Al和B能在高温下反应生成A,A能在氧气中燃烧生成B,铝在高温下能发生铝热反应,则B是金属氧化物,A是金属单质,B和盐酸反应生成C和D,C和氢氧化钠反应生成E,D和氨水反应生成F,E在空气中反应生成F,说明E不稳定,易被氧气氧化,且A、B、C、D、E、F六种物质中均含同一种元素,则A是Fe,B为Fe3O4,C为FeCl2,D为FeCl3,E为Fe(OH)2,F为Fe(OH)3,
(1)A、B、C、D、E、F六种物质中所含的同一种元素是Fe元素,铁元素位于第四周期第Ⅷ族,
故答案为:第四周期Ⅷ族;
(2)反应④是铝和氢氧化钠反应生成偏铝酸钠和氢气,反应离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)D为FeCl3,F为Fe(OH)3,则K为NH3,与盐酸反应生成氯化铵,为强酸弱碱盐,水解呈酸性,溶液pH<7,水解离子方程式为NH4++H2O NH3•H2O+H+,
NH3•H2O+H+,
故答案为:<; NH4++H2O NH3•H2O+H+;
NH3•H2O+H+;
(4)①KClO具有强氧化性,与氢氧化铁发生氧化还原反应生成K2FeO4,反应的离子方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
②K2FeO4具有强氧化性,形成原电池反应时应为正极,发生还原反应,电极方程式为2FeO42-+6e-+8 H2O=2Fe(OH)3+10 OH-,
故答案为:正;2FeO42-+6e-+8 H2O=2Fe(OH)3+10 OH-.
点评 本题考查无机物的推断,注意推断的关键点:①G为主族元素的固态氧化物,在电解条件下生成I和H,能与NaOH溶液反应,说明为Al2O3,②铝和B高温下发生反应,说明为铝热反应,再结合物质的其它性质分析解答,题目难度较大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
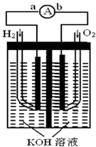 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO3 | B. | FeCl2 | C. | Na2SO3 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60气化和I2升华克服的作用力相同 | |
| B. | 甲酸甲酯和乙酸的分子式相同,它们的熔点相近 | |
| C. | 氯化钠和氯化氢溶于水时,破坏的化学键都是离子键 | |
| D. | 用作高温结构陶瓷材料的固体是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③⑤ | C. | ②④ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Ag2S沉淀溶解电离方程式:Ag2S(s)?2Ag+(aq)+S2-(aq) | |
| C. | Fe3O4与稀硝酸溶液反应:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 5.6g | C. | 33.6g | D. | 22.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ①>②>④>③>⑤ | D. | ①>②>③>⑤>④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com