
| A、V1>V2>V3 |
| B、V3=V2>V1 |
| C、V1=V2>V3 |
| D、V3>V2=V1 |


科目:高中化学 来源: 题型:
 氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
| N2 | H2 | NH3 | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L乙醇中含有的碳原子数目为2NA |
| B、1mol CnH2n含有的共同电子对数为(3n+1)NA |
| C、1mol CO2与1mol Na2O2完全反应时,转移的电子数目为NA |
| D、1mol/L的FeCl3溶液中,所含Fe3+的数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
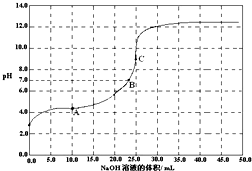 常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )
常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )| A、滴定前,酸中c(H+) 等于碱中c(OH-) |
| B、在A点,c(Na+)>c(X-)>c(HX)>c(H+)>c(OH-) |
| C、在B点,两者恰好完全反应 |
| D、在C点,c(X-)+c(HX)=0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| B、密度:CCl4>CHCl3>H2O>苯 |
| C、同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 |
| D、同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

c(HC
| ||
c(C
|
| O | - 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、原混合液中n(N
| ||
B、原混合液中c(S
| ||
| C、原混合液中pH=1-lg1.2 | ||
| D、溶解的Fe粉质量为2.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、已知
| ||||||||||
B、常温下
| ||||||||||
| C、在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3?H2O | ||||||||||
| D、向浓度均为0.1 mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com