
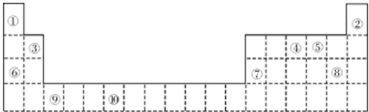
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
分析 根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、He、Be、N、O、Na、Al、Cl、Sc、Cr元素,
(1)元素⑤为O元素,根据价电子排布式为2s22p4判断未成电子数;
(2)水中存在氢键导致水分子发生缔合导致其测量值偏大;
(3)要证明元素的存在,利用原子光谱上的特征谱线来鉴定元素;
(4)元素⑦与元素③的氢氧化物有相似的性质,根据氢氧化铝和氢氧化钠溶液反应方程式书写;
(5)(Ⅰ)根据电离能变化知,R和U可能处于第IA族;
(Ⅱ)根据电离能变化知,T元素可能属于第IIIA族元素,其最后填入的电子是p电子,所以最可能是p区元素;若T为第二周期元素,为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z是Cl元素,则B元素、Cl形成的化合物是BCl3,氯化硼分子中B原子价层电子对个数是3且不含孤电子对,所以为平面三角形结构,则键角是120°;
(6)(Ⅰ)Cr的价电子为3d54s1,同周期中K的价电子为4s1,Cu的价电子为3d104s1;
(Ⅱ)CCl4、CS2等为非极性分子,非极性分子易溶于非极性分子.
解答 解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨⑩分别是H、He、Be、N、O、Na、Al、Cl、Sc、Cr元素,
(1)元素⑤为O元素,价电子排布式为2s22p4,未成电子数为2,故答案为:2;
(2)水中存在氢键导致水分子发生缔合导致其测量值偏大,故答案为:分子间存在氢键,H2O分子发生缔合;
(3)要证明元素的存在,利用原子光谱上的特征谱线来鉴定元素,即证明太阳上是否含有He元素,利用光谱分析,故答案为:光谱分析;
(4)元素⑦与元素③的氢氧化物有相似的性质,根据氢氧化铝和氢氧化钠溶液反应方程式书写元素③的氢氧化物与NaOH溶液反应的离子方程式,氢氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,则氢氧化铍和氢氧化钠溶液反应生成偏铍酸钠和水,离子方程式为2OH-+Be(OH)2=BeO22-+2H2O,
故答案为:2OH-+Be(OH)2=BeO22-+2H2O;
(5)(Ⅰ)根据电离能变化知,R和U可能处于第IA族、T可能处于第IIIA族,故答案为:R和U;
(Ⅱ)根据电离能变化知,T元素可能属于第IIIA族元素,其最后填入的电子是p电子,所以最可能是p区元素;若T为第二周期元素,为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z是Cl元素,则B元素、Cl形成的化合物是BCl3,氯化硼分子中B原子价层电子对个数是3且不含孤电子对,所以为平面三角形结构,则键角是120°,故答案为:p;IIIA;120°;
(6)(Ⅰ)Cr的价电子为3d54s1,同周期中K的价电子为4s1,Cu的价电子为3d104s1,则与Cr同周期的所有元素的基态原子中最外层电子数与Cr原子相同的元素有K、Cu,故答案为:K、Cu;
(Ⅱ)CCl4、CS2等为非极性分子,非极性分子易溶于非极性分子,MO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,则MO2Cl2是非极性分子,故答案为:非极性.
点评 本题考查了元素周期表和元素周期律的综合应用,涉及键角的判断、根据电离能确定元素所处主族、氢键等知识点,根据价层电子对互斥理论确定分子空间构型、氢键对物质性质的影响等知识点分析解答,会利用知识迁移的方法解答(4)题,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 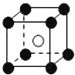 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6个碳原子都在一条直线上 | B. | 有可能5个碳原子在一条直线上 | ||
| C. | 6个碳原子都在同一平面上 | D. | 6个碳原子不可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
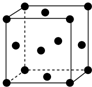 (1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.
(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体根据结构和性质只可分为分子晶体,原子晶体,离子晶体和金属晶体四大类 | |
| B. | 含有阳离子的晶体一定是离子晶体,且离子晶体中可能含有共价键 | |
| C. | 任何晶体中部分含有化学键,如离子键、共价键、金属键、氢键等 | |
| D. | 原子晶体的熔沸点不一定高于离子晶体,而离子晶体的熔沸点肯定高于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性比硫强 | B. | 原子序数为34 | ||
| C. | 氢化物比HBr稳定 | D. | 最高价氧化物的水化物显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
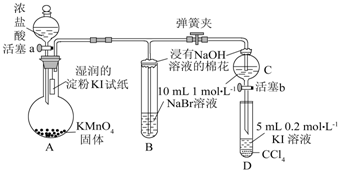
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N | B. | S | C. | Al | D. | O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定含有甲烷 | B. | 可能有乙烯 | ||
| C. | 一定不含有乙烷 | D. | 一定含有乙烯,不一定含有甲烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com