
【题目】常用调味剂花椒油是一种从花椒籽中提取的挥发性香精油,高温易被氧化,易溶于乙瞇、乙 醇等有机溶剂。利用如图所示,水蒸气蒸馆装置处理花椒籽粉,经分离提纯得到花椒油。水蒸气蒸馆可以在较低的温度(略低于100度)下把沸点较高的不溶于水的液体蒸出。

实验步骤:
(一)在A装置中的圆底烧瓶中装入2/3容积的水,加1-2粒沸石。同时,在B中的圆底烧瓶中加入209g花椒籽粉和50mL水。
(二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。
(三)向馏出液中加入食盐至饱和,再用乙醚萃取,萃取后的醚层加入少量无水Na2SO4;将萃取后的有机层倾倒入蒸馏烧瓶中,蒸馏得花椒油。
(1)装置A中玻璃管的作用是_______。
(2)步骤(三)中,用50mL乙醚萃取的最佳方法是______。
A.直接用50 mL乙醚萃取分液
B.将溶液分两份,乙醚也分两份,分别萃取,萃取液合并
C.先用30 mL乙醚萃取分液,再分别用10 mL乙醚萃取两次,并将三次萃取液合并
(3)在馏出液中加入食盐的作用是___ ;加入无水Na2SO4的作用是_____。
(4)相比直接蒸馏,水蒸气蒸馏法的优点有______。
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加入80.00mL0.5mol/LNaOH的乙醇溶液,搅拌,充分反应,加水配成200mL溶液。取25.00mL所配溶液,加入_____做指示剂,用0.1mol/L盐酸进行滴定,滴定终点消耗盐酸20.00 mL。则该花椒油中含有油脂_____g/L(以 计,式量:884)。
计,式量:884)。
【答案】平衡气压,以免关闭弹簧夹后圆底烧瓶内气压过大 C 降低花椒油在水中的溶解度,有利于分层 除去花椒油中的水或干燥 降低蒸馏温度,防止其在高温下被氧化 酚酞 353.6
【解析】
(1)A产生大量的气体,根据气压分析;
(2)多次萃取可提高萃取效果;
(3)根据花椒油的溶解性分析;无水Na2SO4吸水;
(4)水蒸气蒸馏法易控制温度;
(5)盐酸滴定过量的NaOH,则过量的n(NaOH)=n(HCl)=0.1mol/L×0.02L×![]() =0.016mol,则参与水解反应的n(NaOH)=0.5mol/L×0.08L=0.04mol-0.016mol=0.024mol,故花椒油中的油脂物质的量为
=0.016mol,则参与水解反应的n(NaOH)=0.5mol/L×0.08L=0.04mol-0.016mol=0.024mol,故花椒油中的油脂物质的量为![]() ×0.024mol=0.08mol,据此计算。
×0.024mol=0.08mol,据此计算。
(1)A中产生大量蒸汽,A中玻璃管可以平衡气压,以免关闭弹簧夹后圆底烧瓶内气压过大;
(2)50mL乙醚萃取分液,先用30mL乙醚萃取分液,再分别州l0mL乙醚萃取两次,并将三次萃取液合并,除去呋喃甲醇的效果较好;故答案为C;
(3)花椒油不溶于水,在馏出液中加入食盐可以降低花椒油在水中的溶解度,有利于分层;无水Na2SO4可以除去花椒油中的水或干燥;
(4)直接蒸馏不易控制温度,而采用水蒸气蒸馏可降低蒸馏温度,防止花椒油在高温下被氧化;
(5)用盐酸滴定NaOH溶液常选择酚酞作指示剂;盐酸滴定过量的NaOH,则过量的n(NaOH)=n(HCl)=0.1mol/L×0.02L×![]() =0.016mol,则参与水解反应的n(NaOH)=0.5mol/L×0.08L=0.04mol-0.016mol=0.024mol,故花椒油中的油脂物质的量为
=0.016mol,则参与水解反应的n(NaOH)=0.5mol/L×0.08L=0.04mol-0.016mol=0.024mol,故花椒油中的油脂物质的量为![]() ×0.024mol=0.008mol,则该花椒油中含有油脂为
×0.024mol=0.008mol,则该花椒油中含有油脂为![]() =353.6g/L。
=353.6g/L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为_________________。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式________________________________。
(2)由A、B两种元素组成的18电子微粒的分子式为____________________。
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将4.48L的NO2和NO组成的混合气体通入100mL的水中,气体体积缩小为2.24L,假设溶液的体积不变,则下列说法中错误的是( )
A.所得溶液中溶质的物质的量浓度为1.0mol·L-1
B.剩余气体中氮元素与氧元素的质量为7∶8
C.原混合气体中NO2和NO的体积比为1∶1
D.反应过程中转移的电子总数为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列两个图象:

下列反应中符合上述图象的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温室效应是由于大气里温室气体(二氧化碳、甲烷等)含量增大而形成的。回答下列问题:
(1)利用CO2可以制取甲醇,有关化学反应如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g ) ΔH1=-178 kJ·mol-1
②2CO(g)+O2(g)2CO2(g) ΔH2=-566 kJ·mol-1
③2H2(g)+O2(g)2H2O(g) ΔH3=-483.6 kJ·mol-1
已知反应①中相关的化学键键能数据如下:
化学键 | C—C | C—H | H—H | C—O | H—O |
键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 463 |
由此计算断开1 mol C![]() O需要吸收____________kJ的能量。
O需要吸收____________kJ的能量。
(2)甲烷燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC工作原理如图所示:通入a气体的电极是原电池的______极(填“正”或“负”),其电极反应式为______。

(3)如图是用甲烷燃料电池(电解质溶液为KOH溶液)实现铁上镀铜,则b处通入的是____(填“CH4”或“O2”),电解前,U形管的铜电极、铁电极的质量相等,电解2min后,取出铜电极、铁电极,洗净、烘干、称量,质量差为12.8g,在通电过程中,电路中通过的电子为_____mol,消耗标准状况下CH4______mL.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

(1)反应Ⅰ:2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)===SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。p2___p1(填“>”或“<”),得出该结论的理由是____。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+===S↓+2I2+2H2O
ⅱ.I2+2H2O+_____===_____+____+2I-
(4)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)

①B是A的对比实验,则a=_____。
②比较A、B、C,可得出的结论是_______。
③实验表明,SO2的歧化反应速率D>A。结合ⅰ、ⅱ反应速率解释原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①干冰与CO2; ②白磷与红磷; ③![]() Cl与
Cl与![]() Cl;
Cl;
④液氯与氯水; ⑤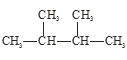 与
与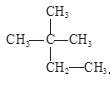 。
。
在上述各组物质中:
(1)互为同位素的是_____________;
(2)互为同素异形体的是__________,
(3)互为同分异构体的是_________;
(4)属于同种物质的是_________。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
3Z(g) △H=-a kJ.mol-1(a>0)。下列说法不正确的是
A. 升高反应温度,逆反应速率增大,正反应速率增大
B. 达到化学平衡状态时,X、Y、Z的质量不再发生变化
C. 达到化学平衡状态时,反应放出的总热量可达akJ
D. X和Y充分反应生成Z的物质的量不可能达到3 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com