
下列实验能达到预期目的的是 ( )
编号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
C | 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp: Mg(OH)2 >Fe(OH)3 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
B
【解析】
试题分析:A.NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比较HClO和CH3COOH的酸性强弱。错误。B. Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+而使溶液显碱性,因此向该盐的水溶液中滴加酚酞变为红色。若向含有酚酞的Na2CO3溶液中加入少量BaC12固体,会发生反应:CO32-+Ba2+=BaCO3↓,使CO32-的水解平衡逆向移动。水解程度减小,所以溶液的减小减弱,溶液红色变浅。正确。C. 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀。但是该沉淀存在沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),当再滴加2滴0.1 mol/LFeCl3溶液时由于,c(Fe3+)·c(OH-)≥Ksp [Fe(OH)3],所以又生成红褐色沉淀。由于Mg(OH)2 和Fe(OH)3的构型不同,因此这只能证明沉淀在溶液中存在沉淀溶解平衡,而不能证明其Ksp的大小。错误。D.证明元素的非金属性的强弱,要看其最高价氧化物对应的水化物的酸性强弱。Na2SO3不是S的最高价含氧酸的钠盐。错误。
Mg2+(aq)+2OH-(aq),当再滴加2滴0.1 mol/LFeCl3溶液时由于,c(Fe3+)·c(OH-)≥Ksp [Fe(OH)3],所以又生成红褐色沉淀。由于Mg(OH)2 和Fe(OH)3的构型不同,因此这只能证明沉淀在溶液中存在沉淀溶解平衡,而不能证明其Ksp的大小。错误。D.证明元素的非金属性的强弱,要看其最高价氧化物对应的水化物的酸性强弱。Na2SO3不是S的最高价含氧酸的钠盐。错误。
考点:考查实验操作与实验目的的关系的知识。


科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
必须通过加入其它试剂才能鉴别的一组无色溶液是
A.氯化铝溶液和氢氧化钾溶液 B.碳酸氢钠和稀盐酸
C.偏铝酸钠溶液和稀硝酸 D.碳酸钠和稀硫酸
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:填空题
(12分)A、B、C、D 四种主族元素原子序数均在20以内,A元素所处的周期数、主族序数、原子序数均相等,B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3 ,C元素原子的最高正价为+6价,C的阴离子与D的阳离子具有相同的电子排布,D可与C形成化合物D2C。
(1)D元素的名称_______;B在周期表中的位置:第_______周期第_______族
(2)A、B形成的化合物以_______共价键相结合(填极性或非极性)
(3)以C的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,放电时则负极区溶液的pH_______(填增大、减小、不变)
(4)以D的最高价氧化物对应的水化物作为电解质溶液,组成氢氧燃料电池,则正极的电极反应式为_____________________
(5)A、B、C、D四种元素简单离子的离子半径由大到小的顺序是(用离子符号表示) ____________________________
(6)C的质子数和中子数相等,则C 的原子组成符号为_______它形成的氢化物的还原性_______氯化氢(填强于或弱于)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:填空题
(14分)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol?L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
(1)写出滴定过程中发生反应的化学方程式为 。
(2)滴定过程中操作滴定管的图示正确的是 。
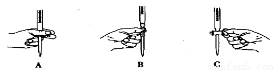
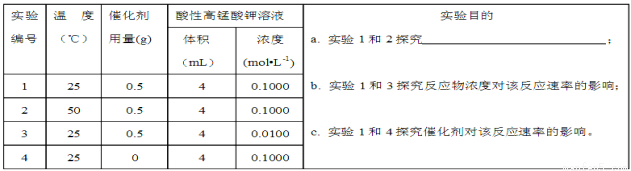
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
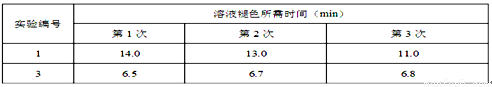
(4)写出表中a 对应的实验目的 ;若50°C时,草酸浓度c(H2C2O4)随反应时间t的变化曲线 如下图所示,保持其他条件不变,请在图中画出25°C时c(H2C2O4)随t的变化曲线示意图。
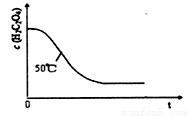
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。甲同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述甲同学改进的实验方案 ______________________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因可用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:填空题
(本题共15分)已知:①RCH2COOH+Cl2 RCHClCOOH+HCl(R为烃基)
RCHClCOOH+HCl(R为烃基)
②R′-ONa+R-CHClCOOH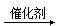 R′-OCHRCOOH+NaCl(R,R’为烃基,可以相同也可以不同)
R′-OCHRCOOH+NaCl(R,R’为烃基,可以相同也可以不同)
有机物E是重要的有机合成中间体,其合成工艺流程如下图所示:
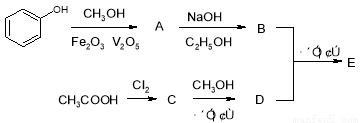
有机物A的相对分子质量为122,其中碳、氢的质量分数分别为78.7%、8.2%。A与溴水取代反应的产物只有一种;A的核磁共振氢谱有4个波峰。
(1)写出A、C的结构简式:A________、C_________。
(2)反应①属于 反应;A→B的反应中,C2H5OH的作用是________________。
(3)写出反应②的化学方程式_________________。
(4)B的系统命名是________________。
(5)有机物D的同分异构体F水解产物酸化后,能发生双分子间酯化反应形成六元环有机物M,则M的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省雅安市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.Na2CO3溶液的水【解析】
CO32- + H3O+ HCO3-+H2O
HCO3-+H2O
B.钢铁吸氧腐蚀时,负极反应式为:4OH――4e-=2H2O+O2↑
C.向Al2(SO4)3溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀:
2Al3++3 SO42-+8OH—+3Ba2+=2AlO2-+ 3BaSO4↓+4H2O
D.氯化亚铁溶液中滴入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ( )
A.1︰2︰3 B.3︰2︰1 C.6︰3︰1 D.6︰3︰2
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高一化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.增大压强,化学反应速率一定增大
B.化学反应速率为反应时间内反应物浓度的增加或者生成物浓度的减少
C.升高温度,化学反应速率一定增大
D.加入反应物,化学反应速率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com