

| A. | 该有机物不同化学环境的氢原子有4种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物在一定条件下能够发生取代反应 |
分析 A.该有机物结构不对称,含8种位置的H原子;
B.含有苯环的有机物属于芳香族化合物;
C.C.Et代表-CH2CH3;
D.该分子中含有醇羟基,能发生取代反应.
解答 解:A.该有机物结构不对称,核磁共振波谱图中有8种峰,含8种位置的H原子,故A错误;
B.该有机物中不含苯环,则不属于芳香族化合物,故B错误;
C.由结构及球棍模型可知,Et代表-CH2CH3,故C错误;
D.该分子中含有醇羟基,能发生取代反应,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查学生识图能力,知道核磁共振氢谱吸收峰与H原子种类关系,易错选项是B.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
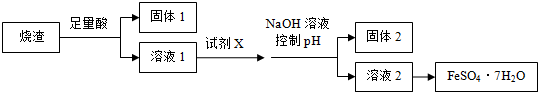
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25 mL 0.1 mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5 mL 0.1mol•L-1 NaOH溶液后,两溶液中离子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )
常温时,向20mL 0.1mol•L-1醋酸溶液中滴加0.1mol•L-1NaOH溶液,滴定曲线如图所示.下列有关说法正确的是( )| A. | a点时升高温度,溶液pH增大 | |
| B. | b点c(CH3COO-)<c(CH3COOH) | |
| C. | c点对应的NaOH溶液的体积V=20mL | |
| D. | d点c(Na+)-c(CH3COO-)=9.9×10-7mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Cl2与NaOH溶液的反应中,每0.1molCl2参加反应时,转移电子的数目为0.2NA | |
| B. | 0.1mol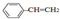 中含有双键的数目为0.4NA 中含有双键的数目为0.4NA | |
| C. | 标准状况下,11.2L乙醇中含有羟基的数目为0.5NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| B. | 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 | |
| C. | 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C | |
| D. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.
氯及其化合物在工业生产、生活中有重要的作用.请按要求回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com