
分析 燃烧后生成一氧化碳,说明氧气不足,完全反应,根据浓硫酸增重可知水的质量,根据碱石灰增重可知二氧化碳的质量,根据质量守恒定律可知一氧化碳的只来那个,进而求得3gA中C、H、O的原子个数比以及A的分子式.
解答 解:(1)浓硫酸增重3.6g,即生成水的质量为3.6g,那么A中含有H元素的物质的量为:$\frac{3.6g}{18g/mol}$×2=0.4mol;
碱石灰增重4.4g,即生成二氧化碳的质量为4.4g,二氧化碳的我的质量为:$\frac{4.4g}{44g/mol}$×1=0.1mol;
n(O2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,m(O2)=0.2mol×32g/mol=6.4g,
根据质量守恒定律可得:m(有机物)+m(O2)=m(CO)+m(CO2)+m(H2O),
则:m(CO)=3g+6.4g-3.6g-4.4g=1.4g,故CO的物质的量为:$\frac{1.4g}{28g/mol}$=0.05mol,那么A中含有C元素的物质的量为0.1mol+0.05mol=0.15mol,
答:3gA中所含氢元素和碳元素的物质的量各是0.4mol和0.15mol;
(2)3gA中:n(C)=0.15mol,
n(H)=0.4mol,
n(O)=$\frac{3g-0.4g-0.15mol×12g/mol}{16g/mol}$=0.05mol,
所以3gA中C.H.O的原子个数比为0.15mol:0.4mol:0.05mol=3:8:1,据此得出A的实验式为C3H8O,达到饱和,则分子式为C3H8O,
答:该有机物的分子式为:C3H8O;
(3)A的核磁共振氢谱中出现三个信号峰,且强度之比为3:3:2,即此有机物含有2个甲基一个亚甲基,结构简式为:CH3CH2OCH3,解为甲乙醚,
答:该有机物的结构简式为CH3CH2OCH3.
点评 本题主要考查有机物分子式的确定,题目难度中等,注意从质量守恒的角度解答该类题目,第(3)问中注意利用核磁共振氢谱确定不同环境H原子的个数.


科目:高中化学 来源: 题型:解答题
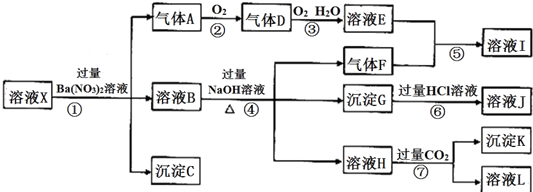
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: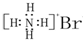 | |
| B. | S的结构示意图: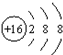 | |
| C. | 次氯酸的结构式:H-Cl-O | |
| D. | 原子核内有18个中子的氯原子:${\;}_{17}^{35}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与氢气反应的难易程度 | B. | 氢化物的熔沸点 | ||
| C. | 非金属性的强弱 | D. | 氢化物稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,BA2的结构式是:S=C=S.
,BA2的结构式是:S=C=S.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 分子式 | 熔点℃ | 沸点℃ | 密度g•cm-3 | 水溶性 |
| A | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| B | C4H8O2 | -84 | 97 | 0.90 | 可溶 |
| A. | 萃取 | B. | 升华 | C. | 分馏 | D. | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 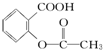 转变为
转变为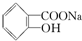 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ | |
| B. | Ca2++2ClO-+2SO2+2H2O→CaSO4↓+2Cl-+2H++SO42- | |
| C. | Ca2++3ClO-+3SO2+3H2O→CaSO4↓+3Cl-+6H++2SO42- | |
| D. | Ca2++3ClO-+SO2+H2O→CaSO4↓+2HClO+Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com