
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |

分析 在第二、三周期元素中,主族元素的最高化合价与其族序数相等,故①③为第ⅠA族,⑤⑦为第ⅤA族,②为第ⅡA族,同一主族元素,原子半径随着原子序数增大而增大,所以在⑤⑦中,⑤是P元素,⑦是N元素,在①③中,①的半径最大,所以①是Na元素,③的半径小于氮,所以③是H元素,由于②的半径小于①大于⑤,所以②是Mg元素,④为第ⅢA族,半径小于镁元素大于磷元素,所以④是Al元素,⑥为第ⅤⅡA族,半径小于磷而大于氮,所以⑥是Cl元素,⑧为第ⅥA族,半径小于氮元素,所以⑧是O元素,故①是Na元素、②Mg元素、③是H元素、④是Al元素、⑤是P元素、⑥是Cl元素、⑦是N元素、⑧是O元素,据此答题.
解答 解:在第二、三周期元素中,主族元素的最高化合价与其族序数相等,故①③为第ⅠA族,⑤⑦为第ⅤA族,②为第ⅡA族,同一主族元素,原子半径随着原子序数增大而增大,所以在⑤⑦中,⑤是P元素,⑦是N元素,在①③中,①的半径最大,所以①是Na元素,③的半径小于氮,所以③是H元素,由于②的半径小于①大于⑤,所以②是Mg元素,④为第ⅢA族,半径小于镁元素大于磷元素,所以④是Al元素,⑥为第ⅤⅡA族,半径小于磷而大于氮,所以⑥是Cl元素,⑧为第ⅥA族,半径小于氮元素,所以⑧是O元素,故①是Na元素、②Mg元素、③是H元素、④是Al元素、⑤是P元素、⑥是Cl元素、⑦是N元素、⑧是O元素,
(1)①和⑧能形成原子个数比1:1和2:1的化合物,原子个数比为1:1的化合物为Na2O2,其中存在的化学键为离子键和非极性共价键,
故答案为:离子键和非极性共价键;
(2)由2个⑦的原子和4个③的原子构成的物质为N2H4,它的电子式为

(3)④的最高价氧化物对应水化物为Al(OH)3,①的最高价氧化物对应水化物为NaOH,它们的水溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)A.③是H元素,位于第一周期,④是Al元素处于第三周期,故A正确;
B.Mg离子与氧离子的核外都有10个电子,故B正确;
C.氧在同主族元素中非金属性最强,故C正确;
D.⑤是P元素素与⑦N元素,两者核电荷数之差是8,故D正确;
故答案为:ABCD;
(5)①、⑥、⑧可以形成的盐中原子个数比为1:1:1,该盐的名称为次氯酸钠,它的水溶液与氯化氢的水溶液反应可生成⑥的单质,该反应的离子方程式为ClO-+2H++Cl-═Cl2↑+H2O,
故答案为:次氯酸钠; ClO-+2H++Cl-═Cl2↑+H2O.
点评 本题考查了原子结构和元素周期律的关系,正确推断元素是解本题关键,明确元素周期律的灵活运用,难度不大.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
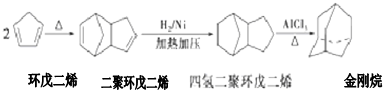
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.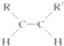 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: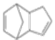 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$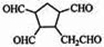 .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):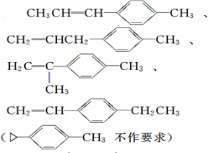 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
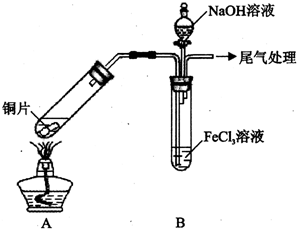 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
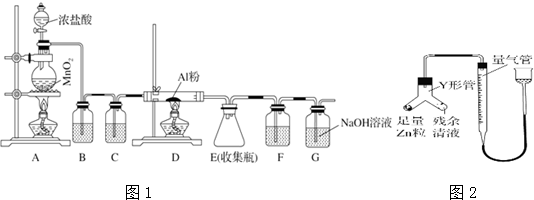
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,11.2L的甲烷气体含有甲烷分子数为0.5 NA | |
| B. | 14g乙烯和丙烯的混合物中总原子数为3 NA | |
| C. | 标准状况下,22.4 L氯仿中含有的氯原子数目为3 NA | |
| D. | 17.6 g丙烷中所含的极性共价键为4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为0.8 mol/(L•s)是指1s时某物质的浓度为0.8mol/L | |
| C. | 根据化学反应速率的大小可以知道化学反应的相对快慢 | |
| D. | 对于任何化学反应来说,反应速率越大,反应现象越明显 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com