
常温下,实验测得1.0mol/LNH4HCO3溶液pH=8.0。平衡时碳的分布系数(各含碳微粒的浓度占含碳各种微粒浓度之和的分数)与pH的关系如图所示。下列说法正确的是
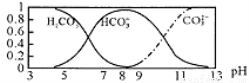
A. 常温下Ka1(H2CO3)>Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在HCO3-的水解平衡
C. pH由8~11时,c(CO32-)·c(H+)/c(HCO3-)不变
D. pH=3时,有c(NH4+)+c(NH3·H2O) =c(HCO3-)+c(CO32-)+c(H2CO3)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:选择题
室温下,下列指定溶液中微粒的浓度关系正确的是( )
A. 0.1mol ·L-1NH4Cl溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH—)
B. 0.1mol ·L-1Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+ c(H2CO3)
C. 向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
D. 0.2mol ·L-1H2C2O4(弱酸)与0.1mol ·L-1 NaOH溶液等体积混合的溶液中:2[c(H+)-c(OH-)]=3c(C2O42-)-c(H2C2O4)+ c(HC2O4-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一下学期分班考试化学试卷(解析版) 题型:选择题
向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A. 该溶液中一定含有SCN- B. 氧化性:Fe3+>Cl2
C. Fe2+与SCN-不能形成红色物质 D. Fe2+被氧化为Fe3+
查看答案和解析>>
科目:高中化学 来源:2017届江西省协作体高三下学期第一次联考理综化学试卷(解析版) 题型:选择题
邻甲基苯甲酸(C8H8O2)常用于农药、医药及有机化工原料的合成,也是目前除草剂—稻无草的主要原料,则邻甲基苯甲酸符合下列条件的同分异构体:
①能与氢氧化钠溶液反应 ②能与新制备的银氨溶液发生银镜反应
③能与金属钠反应且具有甲基的芳香族化合物;共有多少种( )
A. 10 B. 11 C. 12 D. 13
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:填空题
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物,氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物.工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-).
反应方程式为:[Cu(NH3)2]Ac+CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式_____________.
②氨水溶液中各元素原子的电负性从大到小排列顺序为_______________.
③醋酸分子中的两个碳原子,甲基(-CH3)碳和羧基(-COOH)碳的杂化方式分别是___________.
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________.
a.离子键 b.配位键 c.σ键 d.π键
(2)某离子型氢化物化学式为XY2,晶胞结构如图 所示,其中6个Y原子(○)用阿拉伯数字1~6标注.
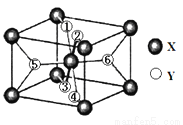
①已知1、2、3、4号Y原子在晶胞上、下面上.则5、6号Y原子均在晶胞__________.(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是_______.a.XY2晶体>硅烷晶体>固态氨 b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体 d.硅烷晶体>固态氨>XY2晶体
(3)一种铜合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为_____;若该晶体的晶胞参数为a pm,则该合金密度为______g/cm3。(列出计算式,不要求计算结果,阿伏伽德罗数的值为NA)
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三下学期开学考试理综化学试卷(解析版) 题型:选择题
化学与人类生产、生活密切相关,下列说法正确的是
A. 减少SO2的排放,可以从根本上消除雾霾
B. 硅酸多孔、吸水能力强,常用作袋装食品的干燥
C. 绿色化学的核心是利用化学原理对环境污染进行治理
D. 医用消毒酒精中乙醇的浓度为95%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
在密闭容器中一定量混合气体发生反应:x A (g) + y B(g)  z C(g)平衡时测得A的浓度为 0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol·L-1,下列判断正确的是
z C(g)平衡时测得A的浓度为 0.5 mol·L-1,保持温度不变,将容器的容积扩大到原来的2倍,再达平衡时测得A的浓度为 0.2mol·L-1,下列判断正确的是
A. 平衡向正反应方向移动 B. x+y > z
C. C的体积分数保持不变 D. B的转化率降低
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省牡丹江市高二上学期开学检测化学试卷(解析版) 题型:选择题
下列事实不能用电化学理论解释的是
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铁可以在氯气中燃烧
C. 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D. 镀锌的铁比镀锡的铁耐用
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省马鞍山市高二上学期期末考试化学试卷(解析版) 题型:选择题
亮菌甲素为利胆解痉药,适用于急性胆嚢炎治疗,其结构简式如图。下列有关叙述中正确的是( )
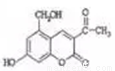
A. 分子中所有碳原子不可能共平面
B. 1mol亮菌甲素与澳水反应最多消耗3molBr2
C. 1mol亮菌甲素在一定条件下与Na0H溶液完全反应最多消耗2molNaOH
D. 1mol亮菌甲素在一定条件下可与6molH2发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com