
分析 (1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式;
(2)A.N5+是由N5分子失去1个电子得到的,1个N5分子是由5个氮原子构成的,据此进行分析解答.
B.N5+离子中每个氮原子均满足8电子结构,每个N原子形成3个共用电子对,还剩一对未成键电子;
C.N5+离子的结构为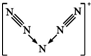 ;
;
(3)①由方程式可知:碳元素由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
②根据无机苯中氮原子和硼原子都采取sp2杂化分析;
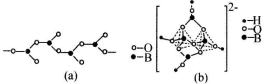
(4)有1个O连着一个B,剩余的两个O分别连着2个B,说明有一个O完全属于B,剩下的两个O,B只占有O的$\frac{1}{2}$;硼砂晶体中阴离子[B4O5(OH)4]2-中一半sp3杂化形成BO4四面体;另一种是sp2杂化形成BO3平面三角形结构;
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为 $\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的 $\sqrt{2}$倍,据此计算.
解答 解:(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,
故答案为:1s22s22p63s23p63d10或[Ar]3d10 ;
(2)A.1个氮原子中含有7个电子,则1个N5分子中含有35个电子,N5+是由N5分子失去1个电子得到的,则1个N5+粒子中有34个电子,故A错误;
B.N5+离子中每个氮原子均满足8电子结构,每个N原子形成3个共用电子对,还剩一对未成键电子,所以N5+离子中存在4对未成键的电子对,故B错误;
C.N5+离子的结构为 ,则N5+阳离子中存在两个氮氮三键,故C正确;
,则N5+阳离子中存在两个氮氮三键,故C正确;
故选:C;
(3)①3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3,
A.由CH4变为CO2,碳原子杂化类型由sp3转化为sp,反应前后碳原子的轨道杂化类型已经改变,故A错误;
B.CH4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,、CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$×(4-2×2)=2,所以二氧化碳是直线型结构,故B正确;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是I1(N)>I1(O)>I1(C)>I1(B),故C正确;
D.B一般是形成3个键,(H3BNH3)由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得,其中1个键是配位键,故D正确;
故答案为:A;
②1个(HB=NH)3分子中硼原子与氮原子间以σ键结合,而剩余的p轨道形成一个共轭大π键.B-H键有3个,N-H键有3个,B-N有σ键有6个,故一共12个;
故答案为:12;
(4)图(a)是一种链状结构的多硼酸根,从图可看出,每个BO32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO32-单元共用,所以B:O=1:(1+2×$\frac{1}{2}$)=1:2,化学式为:[BO2]nn-(或BO2-),从图(b)是硼砂晶体中阴离子的环状结构可看出,[B4O5(OH)4]2-一半sp3杂化形成两个四配位BO4四面体;另一半是sp2杂化形成两个三配位BO3平面三角形结构,
故答案为:[BO2]nn-(或BO2-);sp2、sp3.
(5)根据氯化钠的结构知,氧离子和相邻的镍离子之间的距离为 $\frac{1}{2}$a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的 $\sqrt{2}$倍,所以其距离是 $\frac{\sqrt{2}}{2}$acm,
故答案为:$\frac{\sqrt{2}}{2}$acm.
点评 本题考查学生对物质结构与性质模块的掌握情况,重点考查结构知识,涉及电离能、电子排布式、原子半径、空间结构、杂化轨道、化学式、晶体的计算等,考查知识全面、覆盖广,难度适中,可以衡量学生对该模块主干知识的掌握情况.


科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 5:3 | C. | 5:6 | D. | 6:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中加入氢氧化钠溶液,先有白出现,后白色沉淀逐渐消失 | |
| B. | 将铜片放人氯化铁溶液,钢片表面生成银白色的铁 | |
| C. | 在氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现 | |
| D. | 将铜粉加人冷的浓硝酸中会发生钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增加了 | ||
| C. | 物质B的质量分数减少了 | D. | b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过NaOH溶液后再通过浓硫酸 | B. | 通过CuSO4溶液后再通过石灰水 | ||
| C. | 通过P2O5后再通过固体NaOH | D. | 通过碱石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
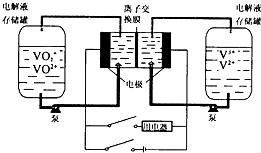
| A. | 充电时阴极的电极反应是V3++e-=V2+ | |
| B. | 放电时,VO2+作氧化剂,在正极被还原,V2+做还原剂,在负极被被氧化 | |
| C. | 若离子交换膜为质子交换膜,充电时当有1mol e-发生转移时,左槽电解液的H+的物质的量增加了1mol | |
| D. | 若离子交换膜为阴离子交换膜,放电时阴离子由左罐移向右罐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:
某无色溶液可能含有NH4+、Na+、Mg2+、Al3+、Fe3+、S042-、S032-、S2032-、C032一中的若干离子.为了探究其组成,分别取溶液100mL进行如下实验:| A. | 溶液中一定含有NH4+、C032- | |
| B. | 溶液中离子浓度c(Na+)=c(S042一) | |
| C. | 溶液中一定不含Mg2+、Al3+、Fe3+ | |
| D. | 溶液可能是由Na2C03与(NH4)2S04组成的混合溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com