
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为:__? ___
它所对应的化学反应为:__? ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol[ | 达到平衡所需时间/min | |
C(s) | H2O(g) | H2(g) | ||||
甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度_______ (填选项字母)。
A.=0.8 mol·L-1??? B.=1.4 mol·L-1??? C.<1.4 mol·L-1??? D.>1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平?? 衡时各气体的体积分数与甲容器完全相同的是_______(填选项字母)。
A.0.6 mol、1.0 mol、0.5 mol、1.0 mol??
B. 0.6 mol、2.0 mol、0 mol、0 mol
C.1.0 mol、2.0 mol、1.0 mol、2.0 mol??????
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
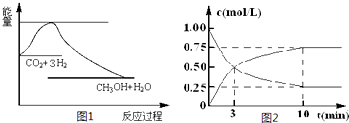
(3)在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,已知CH3OH、H2的燃烧热分别为:△H=-725.5kJ/mol、△H=-285.8kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式:?????????????????????????????? 。
(4)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g)+ 6H2(g) CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2)/ n(CO2)] | 500 K | 600 K | 700 K | 800 K |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% | 15% |
3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H?? 0,熵变△S___0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式?????????????? 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜???????? g。
(1)C(s)+2H2O(g) CO2(g)+ 2H2 (g)(2分)
CO2(g)+ 2H2 (g)(2分)
(2)①12.8 (1分,不写单位不扣分,写错单位不得分)? ②C (2分)③?? AD(2分)
(3)CO2(g)+3H2(g)=CH3OH(l)+H2O(l)? △H=-131.9kJ/mol(2分)
(4)①<(1分),<(1分)
②CH3OCH3 -12e- +16OH-=2CO32- +11H2O(2分)? 9.6(2分)
【解析】
试题分析:(1)表达式中分子为产物,分母为反应物,因为有二氧化碳生成,故还有固体碳参加,固体不写在平衡常数表达式中;
(2)①将容器甲中的相关数据代入平衡常数表达式中,注意将物质的量转化成平衡时的浓度;②三分钟水的转化量为1.2mol,因为起始时浓度大,反应速率快,故1.5分钟水的转化量大于0.6mol,故1.5分钟时水的浓度小于1.4mol/L;(3)写出二氧化碳和氢气反应生成甲醇和水的化学方程式、甲醇和氢气燃烧热的化学方程式,根据盖斯定律得制取甲醇的反应的△H,写出让热化学方程式;(4)①温度升高,二氧化碳的转化率减小,故正反应为放热反应;因为气体系数和减小,故熵变小于零;②负极甲醚失去电子在碱性溶液中生成碳酸根离子和水,通入的甲醚失去电子总数等于铜离子得到电子总数,根据电子守恒算出析出铜的质量。
考点:化学平衡常数表达式、化学平衡的移动、盖斯定律的应用、电极反应式的书写和应用电子守恒计算等知识


科目:高中化学 来源: 题型:
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(g) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com