
【题目】A.《化学与生活》
(1)南通是“世界长寿之都”。合理饮食,正确使用药物对人体健康至关重要。
①下列途径不属于补充人体必需的微量元素的是__________(填字母)。
a.乳制品补钙 b.海产品补碘 c.肉制品补硒
②某品牌饼干的配料标签如图所示,下列法正确的是 _________(填字母)。

a.苯甲酸钠是一种着色剂
b.小麦粉中的主要营养物质是葡萄糖
C.食用植物油在人体内水解生成高级脂肪酸和甘油
③“是药三分毒”说明药物在人体内可能产生不良反应,下列药物可能引起的不良反应叙述错误的是__________(填字母)。
a.青霉素一一过敏反应 b.阿司匹林——胃肠道反应
c.复方氢氧化铝——肠胃穿孔
(2)南通地铁2017年底开工建设,工程建设需要大量水泥、钢铁等材料。
①工业上生产水泥的主要原料是黏土和__________,地铁信息传输系统中使用的光导纤维主要成分是 __________。
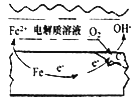
②钢铁在潮湿的空气中易发生吸氧腐蚀(如右图), 正极电极反应式为_____________。
③复合材料“钙塑板”质轻、消声、隔热,以高压聚乙烯、轻质碳酸钙及少量助剂为原料压制而成,聚乙烯的结构简式为__________。
(3)环境友好型城市建设是南通城市规划(20112020年)重点之一。
①2016年,南通市机动车保有量超过200万辆,在机动车尾气系统中装置催化转化器,可将尾气中的NO、CO转化为无害的CO2和__________。
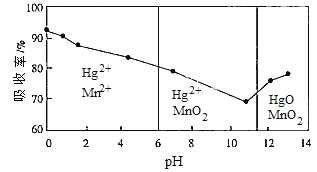
②锌锰电池含有的微量汞单质可用KMnO4吸收液处理。常温下,汞的吸收率及主要反应产物与吸收液的pH的关系如下图。为降低吸收后溶液中Hg2+的浓度,吸收过程中pH> __________。当吸收液的pH<6时,Hg与KMnO4溶液反应的离子方程式为________________。
③脱硫、脫碳是指将燃煤中产生的SO2、CO2去除,减少其排放的过程。向煤中加入适量生石灰,可大大减少SO2的排放,并可回收得到_______________;CO2和H2在催化剂及髙温、高压条件下可以合成乙醇,该反应的化学方程式为_________________。
【答案】acc石灰石SiO2 )O2+2H2O+4e-=4OH-![]() N2 (氮气)112MnO4-+5Hg+16H+=5Hg2++2Mn2++8H2OCaSO4 (CaSO4·2H2O)2CO2+6H2
N2 (氮气)112MnO4-+5Hg+16H+=5Hg2++2Mn2++8H2OCaSO4 (CaSO4·2H2O)2CO2+6H2![]() CH3CH2OH+3H2O
CH3CH2OH+3H2O
【解析】本题考查《化学与生活》中的基础知识,涉及的内容是最基本的知识,(1)①常量元素:碳、氢、氧、氮、钠、镁、钙、磷、硫、钾、氯等11种元素,其余为微量元素,故选项a正确;②a、苯甲酸钠是一种防腐剂,故错误;b、小麦粉主要营养物质为淀粉,故错误;c、植物油是油脂,油脂是高级脂肪酸甘油酯,在人体中水解成高级脂肪酸和甘油,故正确;③a、青霉素的不良反应是过敏反应,故说法正确;b、阿司匹林不良反应是胃肠道反应、水杨酸反应等,故说法正确;c、氢氧化铝与盐酸反应,对人体无害,故说法错误;(2)①生产水泥需要的原料是黏土、石灰石,光导纤维成分是SiO2;②根据原电池的工作原理,正极上得到电子,化合价降低,氧气在正极上得到电子,正极反应式为O2+2H2O+4e-=4OH-;③聚乙烯是乙烯通过发生加聚反应生成的,即聚乙烯的结构简式为:![]() ;(3)①转化成无公害,C转化成CO2,N转化成N2;②根据图像,当pH>11时,溶液Hg2+的浓度最低,因此吸收过程中pH>11时溶液Hg2+浓度最低;pH<6时,Hg以Hg2+形式存在,Mn以Mn2+形式存在,离子反应是MnO4-+Hg→Mn2++Hg2+,,Mn的化合价由+7价→+2价,化合价降低5价,Hg的化合价由0价→+2价,化合价升高+2价,化合价升高2价,最小公倍数为10,即2MnO4-+5Hg→2Mn2++5Hg2+,因为溶液显酸性,因此H+参与反应生成H2O,根据电荷守恒和原子个数守恒进行配平,其离子反应方程式为 2MnO4-+5Hg+16H+=5Hg2++2Mn2++8H2O;③SO2是酸性氧化物,与生石灰反应:SO2+CaO=CaSO3,CaSO3被氧气氧化成CaSO4,2CO2+6H2
;(3)①转化成无公害,C转化成CO2,N转化成N2;②根据图像,当pH>11时,溶液Hg2+的浓度最低,因此吸收过程中pH>11时溶液Hg2+浓度最低;pH<6时,Hg以Hg2+形式存在,Mn以Mn2+形式存在,离子反应是MnO4-+Hg→Mn2++Hg2+,,Mn的化合价由+7价→+2价,化合价降低5价,Hg的化合价由0价→+2价,化合价升高+2价,化合价升高2价,最小公倍数为10,即2MnO4-+5Hg→2Mn2++5Hg2+,因为溶液显酸性,因此H+参与反应生成H2O,根据电荷守恒和原子个数守恒进行配平,其离子反应方程式为 2MnO4-+5Hg+16H+=5Hg2++2Mn2++8H2O;③SO2是酸性氧化物,与生石灰反应:SO2+CaO=CaSO3,CaSO3被氧气氧化成CaSO4,2CO2+6H2![]() CH3CH2OH+3H2O。
CH3CH2OH+3H2O。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中的编号代表所对应的元素。请回答下列问题: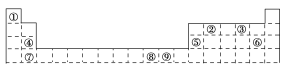
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______________________(写出元素符号),②号元素基态原子的电子排布图为________。
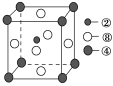
(2)①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的立体构型为________。②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是_______________________________。
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子
b.该分子含有4个σ键和1个π键
c.该分子中的②号原子采取sp2杂化
d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_________________________。
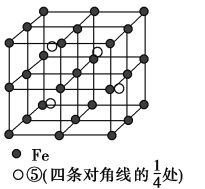
(5)若元素⑤与Fe元素形成的某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A. 0.1mol/L的盐酸和0.1mol/L的氨水溶液
B. 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
C. pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D. pH=4的盐酸和pH=l0的氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步实验直接完成的是( )
A. Al2O3 →Al(OH)3 B. Fe→Fe3O4
C. Al→NaAlO2 D. NaHCO3→Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应:2A(g)+2B(g) ![]() xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1,下列说法正确的是
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol·L-1·min-1,下列说法正确的是
A. A和B的转化率均是20% B. x = 2
C. 平衡时B的物质的量为1.2mol D. 平衡时气体压强比原来减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】24mL 0.05mol/L Na2SO3溶液恰好与20mL 0.02mol/L K2Cr2O7溶液完全反应,则元素Cr在还原产物中的化合价为
A.+6 B. +3 C. +2 D.0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com