
分析 相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为d,则混合气体的平均摩尔质量为2dg/mol,根据质量守恒再结合M=$\frac{m}{M}$计算A的摩尔质量,摩尔质量在数值上等于其相对分子质量.
解答 解:相同条件下,气体的密度之比等于其摩尔质量之比,生成的混合气体对氢气的相对密度为d,则混合气体的平均摩尔质量为2dg/mol,
假设有2molA反应则生成1molB、2molC、2molD,生成物的质量=2dg/mol×(1+2+2)mol=10dg,反应前后质量不变,则A的质量为10dg,其摩尔质量=$\frac{10dg}{2mol}$=5dg/mol,摩尔质量在数值上等于其相对分子质量,所以A的相对分子质量为5d,
故答案为:5d.
点评 本题考查了阿伏伽德罗定律及其推论,明确相同条件下不同气体密度与其相对分子质量的关系是解本题关键,再结合基本公式分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
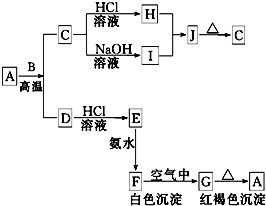 A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
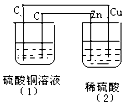 如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )
如图的装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上通过了0.02mole-.若不考虑溶液体积的变化,下列叙述正确的( )| A. | 相同条件下,两容器产生的气体体积相同 | |
| B. | (1)、(2)溶液的pH值均减小 | |
| C. | (1)中阳极电极反应方程式为:4OH--4e-═2H2O+O2↑ | |
| D. | (2)中正极反应为Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 半反应式 | Fe2+表现的性质 | 完成该半反应式选用的物质 |
| A | Fe2++2e-═Fe | 氧化性 | I- |
| B | Fe2++2e-═Fe | 还原性 | Al |
| C | Fe2+-e-═Fe3+ | 氧化性 | Fe |
| D | Fe2+-e-═Fe3+ | 还原性 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com