
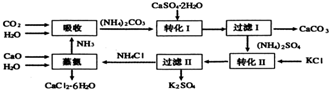
分析 流程图分析:吸收环节NH3、CO2、H2O生成碳酸铵,碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,经过滤后分离,(NH4)2SO4和KCl的饱和溶液中,由于溶解度不同析出K2SO4晶体,过滤分离得到NH4Cl和K2SO4,蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
(1)由上述分析可知,原料除CaSO4.2H2O、CaCO3、H2O外,还需要的两种原料是氨气与氯化钾;
碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4;
(2)利用CO32-与酸反应生成二氧化碳进行检验;
(3)根据Ksp(CaCO3)=c(Ca2+)×c(CO32-)计算;
(4)蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3;
(5)温度过高时CaCl2.2H2O会失去结晶水;氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与能制冷,能导电无关.
解答 解:由流程图可知,吸收环节NH3、CO2、H2O生成碳酸铵,碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,经过滤后分离,(NH4)2SO4和KCl的饱和溶液中,由于溶解度不同析出K2SO4晶体,过滤分离得到NH4Cl和K2SO4,蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
(1)由上述分析可知,原料除CaSO4.2H2O、CaCO3、H2O外,还需要的两种原料是NH3与KCl;
碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,反应离子方程式为:CaSO4+CO32-=CaCO3↓+SO42-,
故答案为:NH3;KCl;CaSO4+CO32-=CaCO3↓+SO42-;
(2)利用CO32-与酸反应生成二氧化碳进行检验,具体操作为:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之,则不含有CO32-,
故答案为:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之,则不含有CO32-;
(3)Ca2+浓度低于1.0×10-5mol•L-1 时可认为被沉淀完全,若要使Ca2+沉淀完全,根据Ksp(CaCO3)=c(Ca2+)×c(CO32-),可知溶液中c(CO32-)>$\frac{5.0×1{0}^{-9}}{1.0×1{0}^{-5}}$mol/L=5.0×10-4mol/L,
故答案为:5.0×10-4mol/L;
(4)蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3,反应方程式为:CaO+NH4Cl+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2.6H2O+2NH3↑,
故答案为:CaO+NH4Cl+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2.6H2O+2NH3↑;
(5)温度过高时CaCl2.2H2O会失去结晶水,蒸发结晶要保持在160℃;氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低,吸收热量易熔化,且无毒,与能制冷,能导电无关,
故答案为:温度过高时CaCl2.2H2O会失去结晶水;ad.
点评 本题考查物质的制备方案、混合物分离提纯的综合应用.溶度积有关计算等,关键是理解工艺流程原理,侧重反应原理的分析及应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH4O | CH2O | CH2O2 | C2H6 | C2H6O | C2H4O | C2H4O2 |
| A. | ①③④ | B. | ②④⑤ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| T(℃) | 527 | 627 | 727 | 827 | 927 |
| 平衡常数K | 910 | 42 | 3.2 | 0.39 | 0.12 |
| A. | 根据平衡常数随温度的变化关系,判断出△H<0 | |
| B. | 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃) | |
| C. | 增大压强、降低温度能提高SO2的转化率 | |
| D. | SO3的稳定性随温度的升高而降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 生成的气体是NH3 |
| B | 向AgI悬浊液中加入NaCl细粒 | 一定不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗了一批做了银镜反应的试管.配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管. | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗得干净 | Fe3+氧化银单质的过程可能是一个可逆过程: Fe3++Ag?Fe2++Ag+ |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为11NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com