
 铁、铝及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁、铝及其化合物在生活、生产中有广泛应用.请回答下列问题:- 2 |
- 2 |
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应甲 | Au+6HNO3?Au(NO3)3+3NO2↑+3H2O | <10-5 |
| 反应乙 | Au3++4Cl-?[AuCl4]- | >105 |
| ||
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
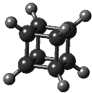
| A、它的一氯代物只有一种同分异构体 |
| B、它的二氯代物有两种同分异构体 |
| C、它的核磁共振氢谱图上只有一个峰 |
| D、它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示ⅡA金属(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是( )
如图表示ⅡA金属(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是( )| A、金属性 |
| B、与水反应的剧烈程度 |
| C、阳离子的氧化性 |
| D、原子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:b>c>a | ||||
| B、常温下5.0×10-3mol?L-1KHA溶液的pH=3.75,该溶液中c(A2-)<c(H2A) | ||||
C、室温时,M(OH)2(s)?M2+(aq)+2OH-(aq) Ksp=a; c(M2+)=b mol?L-1时,溶液的pH等于14+
| ||||
| D、Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(F-)=2×10-4 mol?L-1 |
| B、c(F-)=5×10-5 mol?L-1 |
| C、c(Sr2+)=4.5×10-2 mol?L-1 |
| D、c(Sr2+)=0.1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的屯离程度:①<② |
| B、①、②中粒子浓度关系均符合:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(co32-) |
| C、向③、④中分别加入25 mL 0.l mol?L-1盐酸后,溶液中c(NH4+):③<④ |
| D、将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)=c(NH3?H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在容积为2L的密闭容器中,x、y、z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:
某温度时,在容积为2L的密闭容器中,x、y、z三种气体物质的物质的量随时间的变化曲线如图所示,根据图中数据,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com