
| A. | 乙醚 | B. | 乙醇 | C. | 乙酸乙酯 | D. | 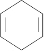 |
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:解答题
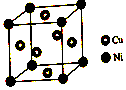 (1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液
(1)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验设计 |
| A | 除去铝箔上少量的氧化膜 | 将铝箔放入 NaOH 溶液中洗涤 |
| B | 排水法收集 KMnO4分解产生的 O2 | 先熄灭酒精灯,后移出导管 |
| C | 检验溶液中是否含有 Fe2+ | 向溶液中滴入氯水后,再滴加 KSCN 溶液 |
| D | 证明 H2SO4酸性比 H2CO3 强 | 把稀 H2SO4 滴入 NaHCO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鲜花运输途中需喷洒高锰酸钾稀溶液,主要是为鲜花补充钾肥 | |
| B. | 牙膏中添加的Na3PO3F、NaF提供的氟离子浓度相等时,它们防治龋齿的作用相同 | |
| C. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2均能代替明矾净水 | |
| D. | 用石灰水或Na2SiO3溶液喷涂在树干上均可消灭树皮上的过冬虫卵 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将过量SO2通入BaCl2溶液中 | 先有白色沉淀生成,后沉淀消失 | 最终生成Ba(HSO3)2 |
| B | 将Cl2通入石蕊试液中 | 先变红后褪色 | Cl2有漂白性 |
| C | 将氨气通入到盛有氯化铝的溶液中 | 先生成白色沉淀,后白色沉淀消失 | 氨水能与氢氧化铝反应 |
| D | 将少量溴水滴加到KI溶液中,再加入CCl4振荡、静置 | 溶液分层,上层无色,下层紫红色 | 氧化性:Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| B. | 用乙醚从黄花蒿中提取青蒿素是利用了氧化还原反应原理 | |
| C. | “丹砂(HgS)烧之成水银,积变又成丹砂.”这个过程是可逆反应 | |
| D. | 丁达尔效应可用于区别溶液与胶体,云、雾、稀硫酸均能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
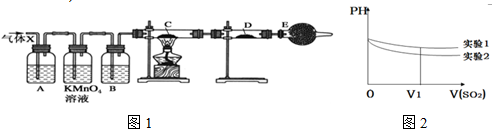
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在盛有不含O2的25ml0.1mol/LBa(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体 |
 2NO+4H++3SO42-;.
2NO+4H++3SO42-;.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.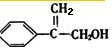 .写出反应⑥的化学方程式(注明必要的反应条件):
.写出反应⑥的化学方程式(注明必要的反应条件): +CH3OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ①③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com