
常温时将pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水(若混合体积变化忽略不计),则下列有关所得混合液说法正确的是()
A. 混合后溶液pH=7
B. 所得混合溶液中c(Na+)>c(CH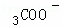 )>c(H+)>c(OH﹣)
)>c(H+)>c(OH﹣)
C. 所得混合溶液中存在c(CH3COOH)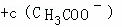 =0.05mol/L
=0.05mol/L
D. 混合后溶液中存在c(Na+)+c(H+)=
考点: 酸碱混合时的定性判断及有关ph的计算.
专题: 电离平衡与溶液的pH专题.
分析: 常温时将pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水,说明醋酸和氢氧化钠的物质的量相等,因为两种溶液的体积相等,则两种溶液的物质的量浓度相等,混合后溶液中的溶质是醋酸钠,根据盐的类型确定溶液的酸碱性,溶液中存在电荷守恒和物料守恒.
解答: 解:常温时将pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合后,恰好完全反应生成盐和水,则醋酸和氢氧化钠的物质的量浓度相等,溶液中的溶质是醋酸钠,
A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,故A错误;
B.醋酸钠的水溶液呈碱性,则c(H+)<c(OH﹣),故B错误;
C.原溶液中c(NaOH)=c(CH3COOH)=0.1mol/L,等体积混合后,体积增大一倍,浓度降为用来的一半,根据物料守恒得c(CH3COOH)+c(CH3COO﹣)=0.05mol/L,故C正确;
D.混合溶液中存在物料守恒,即c(CH3COOH)+c(CH3COO﹣)=c(Na+)=0.05mol/L,故D错误;
故选C.
点评: 本题考查酸碱混合溶液的定性判断,根据物料守恒和电荷守恒来分析解答,注意醋酸中氢离子浓度和酸浓度的关系是解本题关键,难度不大.


科目:高中化学 来源: 题型:
下列说法中不正确的是( )
①质子数相同的粒子一定属于同一种元素
②同位素的性质几乎相同
③质子数相同电子数也相同的两种粒子,不可能是一种分子或一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是其质量数.
|
| A. | ②③⑤⑥ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质分离方法的叙述中,不正确的是()
A. 用过滤的方法分离氯化钠溶液和牛奶的混合物
B. 用蒸馏的方法将自来水制成蒸馏水
C. 用四氯化碳萃取碘水中的碘
D. 用加热的方法分离氯化钠和氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 64g SO2中含有的氧原子数为2NA
B. 含有6.02×1023个H原子的H2在标准状况下的体积约为22.4L
C. 40g NaOH溶解在1L水中,所制得的溶液,物质的量浓度为1mol•L﹣1
D. 标准状况下,11.2L H2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与材料、生活和环境密切相关.下列有关说法中错误的是()
A. 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
B. 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C. 大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D. 新型材料聚酯纤维、光导纤维都属于有机高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验室从如图I标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成.从反应物及实验操作猜测:该黑色物质可能为炭与另一种氧化物组成的混合物.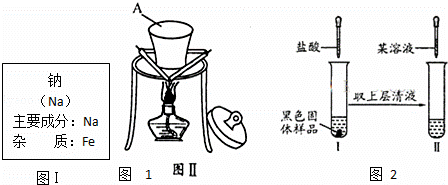
根据题意和图示回答下面问题:
(1)装置图Ⅱ中A的名称
(2)此氧化物可能是FeO或 (写化学式)
(3)对黑色固体物质的组成作如图所示探究
①实验I加入盐酸溶液的目的是 ;
②仅通过实验Ⅱ,用最简步骤能快速确定
黑色氧化物的组成,请完善该设计.(限选试剂:稀盐酸、KSCN溶液、10%H2O2 溶液)
实验操作 预期现象与结论 相关离子方程式
取少量实验Ⅰ中的澄清溶液,加入试剂 . .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度不同压强(p1<p2)下,可逆反应2X(g)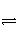
 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,正确的是( )
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,正确的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
将2molI2(g)和1molH2置于某2L的密闭容器中,在一定温度下发生反应:I2(g)+H2(g)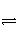
 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间的变化如图曲线(Ⅱ)所示。
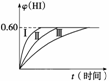 (1)达到平衡时,I2(g)的物质的量浓度为__________
(1)达到平衡时,I2(g)的物质的量浓度为__________
(2)若改变反应条件,在甲条件下φ(HI)的变化如图曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是________(填入下列条件的序号,下同),乙条件可能是__________。
①恒温条件下,扩大反应容器体积 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒容条件下,升高温度 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L的密闭容器中加入amolI2(g)、bmolH2和cmolHI(a、b、c均大于0),发生反应,达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应aA(g)bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
A.平衡向正反应方向移动 B.物质A的转化率增大
C.物质B的质量分数增加 D.a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com