


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、混合后,溶液中肯定有沉淀生成 |
| B、沉淀生成后溶液中Ag+的浓度为1×10-5 mol?L-1 |
| C、沉淀生成后溶液的pH=2 |
| D、混合后,升高温度,溶液中Ag+的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该天然水具有暂时硬度和永久硬度 |
| B、加入适量的明矾,能除去此天然水的硬度 |
| C、将此天然水蒸馏,可得到蒸馏水 |
| D、将此天然水通过装有磺化煤的装置后可使之软化 |
查看答案和解析>>
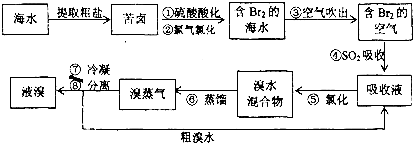
科目:高中化学 来源: 题型:
查看答案和解析>>
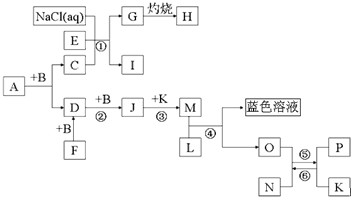
科目:高中化学 来源: 题型:
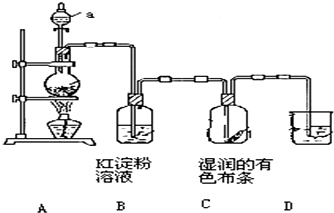
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| B、10mL0.1mol/LNH1Cl与5mL0.2mol/LNaOH两溶液混合:C(Na+)=C(Cl-)>C(OH-)>C(H+) |
| C、10mL0.1mol/L醋酸与5mL0.2mol/L NaOH混合:C(Na+)=C(CH3COO-)>C(OH-)>C(H+) |
| D、10mL0.5mol/LCH3COONa溶液与6mL0.1mol/L盐酸混合:C(Cl-)>C(Na+)>C(OH-)>C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠 | B、氢氧化钾 |
| C、硫酸 | D、硫酸铵 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com