
【题目】下列物质转化中,固体质量减轻且有明显颜色变化的是( )
A.无水硫酸铜粉末吸收水蒸气B.加热碳酸钠和碳酸氢钠混合物
C.氢气通过赤热氧化铜粉末D.金属钠在空气中点燃
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:

(1)试剂a应选用________(填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________(填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式____________________;
(4)实验室制取气体E的离子方程式是________________________,欲对气体E进行干燥和吸收,需选用下列装置中的________(填写序号);

(5)如何用化学方法检验气体E?______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、丙烯等低碳烯烃是重要的基本化工原料,随着我国国民经济的发展,对低碳烯烃的需求日渐攀升。回答下列问题:
(1)MTP(甲醇制丙烯)工艺是目前重要的化工技术。主反应为![]()
![]() 。反应历程可按下列催化过程进行:
。反应历程可按下列催化过程进行:
![]()
![]() 则
则![]() =___________。
=___________。
(2)MTP工艺中存在等多个副反应。其他条件都相同时,在某催化剂的作用下,反应温度对甲醇转化率和产物选择性的影响如图所示。已知:
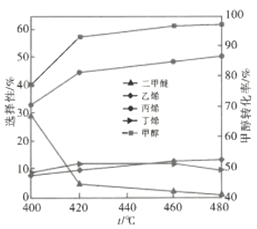
①主、副反应均为放热反应,且均为有水蒸气生成的气体分子数增加的反应
②选择性=(生成目的产物所消耗的原料量/转化掉的原料量)×100%
据图分析,若欲显著提高乙烯的选择性,不宜采取的措施是___________(填“改变温度”或“改变催化剂”);图中温度低于480℃时甲醇的转化率___________(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是___________;下列措施中可提高甲醇平衡转化率的是___________(填标号)。
A.增大甲醇浓度
B.减小压强
C.用干燥剂吸收水蒸气
D.减小反应的平衡常数
(3)恒容条件下,若反应温度为460℃,![]() 初始浓度为
初始浓度为![]() mol
mol![]() ,平衡转化率为
,平衡转化率为![]() ,丙烯的选择性为48.3%,水蒸气的平衡浓度为
,丙烯的选择性为48.3%,水蒸气的平衡浓度为![]() ,则丙烯的平衡浓度为_____________,主反应
,则丙烯的平衡浓度为_____________,主反应![]() 的平衡常数K(460℃)的计算式为___________。
的平衡常数K(460℃)的计算式为___________。
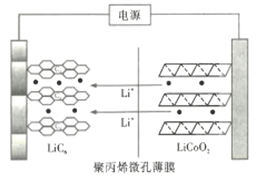
(4)丙烯可用于制备聚丙烯,聚丙烯微孔薄膜可用作锂离子电池的隔膜。某种锂离子电池充电时的示意图如图所示。![]() 中的
中的![]() 穿过隔膜向左迁移并嵌入石墨(用
穿过隔膜向左迁移并嵌入石墨(用![]() 表示)中。放电时
表示)中。放电时![]() 中的
中的![]() 又脱嵌向右迁移,则该电池放电时负极的电极反应式为___________。
又脱嵌向右迁移,则该电池放电时负极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。

(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知20℃时:K(C6H5OH)=1.2×10-10、K(CH3COOH)=1.8×10-5、K(H2CO3)=4.3×10-7、K(HCO3-)=5.6×10-11、K(HCN)=4.9×10-10。
(1)请根据上述信息求Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa的化学平衡常数K=__________;
NaHCO3+C6H5ONa的化学平衡常数K=__________;
(2)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9molL-1,则该电解质可能是_________(填序号);
A.CuSO4 B.HCl C.Na2S D.NaOH E.K2SO4
(3)常温下,将pH=3的盐酸a L分别与下列三种溶液混合,结果溶液均呈中性。①浓度为1.0×l0-3mol·L-1的氨水b L;②c(OH-)=1.0×10-3mol·L-1的氨水c L;③c(OH-)=1.0×10-3molL-1的氢氧化钡溶液d L。则a、b、c、d之间由大到小的关系是_________;
(4)室温时,向0.2molL-1的醋酸溶液中加入等体积的0.1molL-1的NaOH(aq),充分反应后所得溶液的pH=4,则所得溶液中各离子浓度大小关系是________________,所得溶液中的物料守恒式为:________+________=__________=_________ molL-1,所得溶液中c(CH3COOH)=____________________molL-1(写出算式,不做计算);
(5)已知常温时Ksp(AgCl)=1.8×10-10mol2L-2,向50mL 0.018molL-1的AgNO3溶液中加入相同体积0.020molL-1的盐酸,则c(Ag+)=_______________,此时所得混合溶液的pH=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用盐酸标准液滴定未知浓度的NaOH溶液,下列各操作中会引起实验误差的是( )
A. 滴定前酸式滴定管需用盐酸标准液润洗
B. 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定
C. 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定
D. 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com