
| A. | 稀硫酸 | B. | 氨水 | C. | AgNO3 溶液 | D. | NaOH溶液 |
分析 五种溶液中的阳离子不同,可选择碱溶液,利用不同现象来鉴别.
解答 解:A.均与稀硫酸不反应,不能鉴别,故A不选;
B.氨水不能鉴别NH4Cl、MgCl2、AlCl3,故B不选;
C.均与硝酸银反应生成白色沉淀,不能鉴别,故C不选;
D.NH4Cl、MgCl2、FeSO4、AlCl3、FeCl3五种溶液分别与NaOH混合的现象为:刺激性气体、白色沉淀、白色沉淀迅速变为灰绿色最后为红褐色、先生成白色沉淀后消失、红褐色沉淀,现象不同,可鉴别,故D选;
故选D.
点评 本题考查物质的鉴别和检验,为高频考点,把握发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:解答题
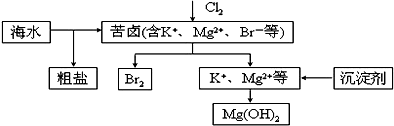 氯气在实验室和生产中都有重要的应用.
氯气在实验室和生产中都有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①⑤ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
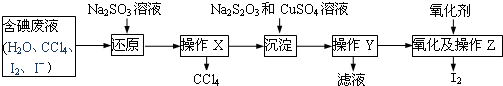
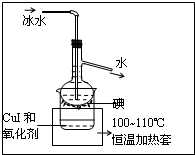
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
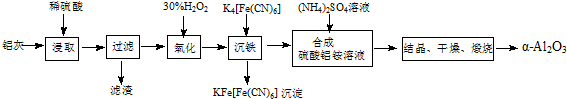
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
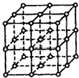 如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.
如图所示,直线交点处的圆圈为NaCl晶体中Na+离子或Cl-离子所处的位置.这两种离子在空间三个互相垂直的方向上都是等距离排列的.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com