
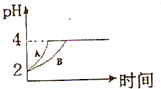
 现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②醋酸、③氨水、④NaOH溶液,回答下列问题:
现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②醋酸、③氨水、④NaOH溶液,回答下列问题:分析 (1)将等体积的①、③混合是盐酸和氨水恰好完全反应生成氯化铵溶液,铵根离子水解溶液显酸性;
(2)将②醋酸、④NaOH溶液混合后,若溶液呈中性,酸应略微过量,溶液中为醋酸和醋酸钠的混合溶液;
(3)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢.
解答 解:(1)将等体积的①、③混合是盐酸和氨水恰好完全反应生成氯化铵溶液,铵根离子水解溶液显酸性,离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:<;NH4++H2O?NH3•H2O+H+;
(2)将②醋酸、④NaOH溶液混合后,若溶液呈中性,酸应略微过量,则消耗两溶液的体积②>④,溶液中为醋酸和醋酸钠的混合溶液溶液中各离子的浓度由大到小的顺序为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:>;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(3)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<.
点评 本题考查了弱电解质电离平衡、酸碱反应溶液酸碱性的判断、电解质溶液中电荷守恒和离子浓度比较,题目难度中等.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①④⑤ | C. | ①⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤 | |
| B. | 将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体 | |
| C. | 失去标签的硝酸银溶液、稀盐酸、氢氧化钠溶液、氯化铝溶液,可以用碳酸铵溶液鉴别 | |
| D. | 检验从火星上带回来的红色物体是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
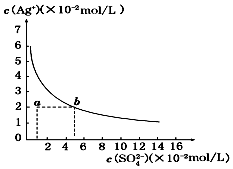
| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol/L的AgNO3溶液与0.2 mol/L的Na2SO4溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (C)=3 mol/(L•min) | B. | v (D)=0.5 mol/(L•s) | ||
| C. | v (B)=0.6 mol/(L•s) | D. | v (A)=12 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com