
分析 (1)据题意得,铁和硝酸反应生成硝酸铁,硝酸铵和水;
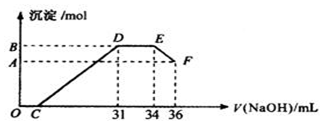
(2)D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,以此书写离子方程式;
(3)根据反应图象结合反应的离子方程式计算.
解答 解:(1)据题意得,铁和硝酸反应生成硝酸铁,硝酸铵和水,故方程式为8Fe+30HNO3═8Fe (NO3)3+3NH4NO3+9H2O,
故答案为:8Fe+30HNO3═8Fe (NO3)3+3NH4NO3+9H2O,
(2)D与E一段沉淀的质量没有发生变化,该反应为NH4NO3和NaOH反应,反应的离子方程式为:NH4++OH-═NH3•H2O,
故答案为:NH4++OH-═NH3•H2O;
(3)由图可知,EF段消耗的氢氧化钠溶液为36mL-34m=2mL,故该计算参加反应的氢氧化钠的物质的量为:0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH-=
AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol;金属混合物中含有铝0.008mol,设铁为xmol,Al为0.008mol,生成硝酸铵为:(34-31)×0.001L×4mol/L=0.012mol,由于显示过量,铁反应生成了硝酸铁,由电子守恒可知,3x+0.008×3=0.012×8,解得x=0.024mol,故铁和铝的物质的量之比为0.024:0.08=3:1,
故答案为:3:1.
点评 本题考查较为综合,涉及铝热反应,金属与硝酸的反应、离子方程式的书写、氧化还原反应、化学计算等知识点,属于中等难度试题;解答此题关键是判断出硝酸的还原产物以及电子转移守恒的运用


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物是麦芽糖 | |
| B. | 丙烯分子中三个碳原子处于同一直线上 | |
| C. | 二氯甲烷只有一种结构,可证明甲烷是正四面体构型 | |
| D. | 符合分子式为C4H10O能与金属钠反应的有机物有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化锂是一种电解质 | B. | LiH是离子晶体[ | ||
| C. | LiH是一种强氧化剂 | D. | LiH中Li+半径小于H-半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| BaCl2溶液体积/mL | 0 | 30 | 60 | 100 | 120 |
| 沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
| A.混合前,BaCl2溶液的物质的量浓度为0.10mol•L-1 |
| B.混合前,Na2SO4溶液的物质的量浓度为0.15mol•L-1 |
| C.3号实验中沉淀的质量x为1.398g |
| D.完全沉淀60mL Na2SO4溶液消耗BaCl2溶液的体积为80mL |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| D. | 将制得晶体转移到新制过滤器中用大量水进行洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入可溶性硅酸盐中析出硅酸沉淀,所以硅酸的酸性小于碳酸 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | 二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用水浴加热法控制温度 | |
| B. | 采用边反应边蒸馏的方法提高产率 | |
| C. | 制取装置中有冷凝回流措施 | |
| D. | 用水和氢氧化钠溶液洗涤后分液分离出产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:MH+OH--e-═M+H2O | |
| B. | 放电时,每转移1mol电子,有1mol NiOOH被氧化 | |
| C. | 充电时正极反应为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| D. | 电池电解液可用KOH溶液,充电过程中KOH浓度减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com