
| A. | KNO3 NaCl NaOH | B. | KOH Na2CO3 HCl | ||
| C. | KNO3 NaOH FeCl3 | D. | AgNO3 BaCl2 HNO3 |
分析 A.三种物质之间不发生反应,能够共存;
B.碳酸钠、氢氧化钾都与氯化氢发生反应;
C.氯化铁与氢氧化钠发生反应;
D.硝酸银与氯化钡反应生成氯化银沉淀.
解答 解:A.KNO3、NaCl、NaOH之间不发生反应,在溶液中能够大量共存,故A正确;
B.KOH、Na2CO3与HCl发生反应,在溶液中不能大量共存,故B错误;
C.NaOH、FeCl3之间反应生成氢氧化铁沉淀,在溶液中不能大量共存,故C错误;
D.AgNO3、BaCl2之间反应生成难溶物氯化银,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查了离子反应发生条件及其应用,题目难度不大,明确离子反应发生条件为解答关键,试题侧重考查复分解反应发生条件,有利于培养学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题

| A. | 该反应可表示为:2A(g)+B(g)?C(g)△H<0 | |
| B. | t℃时该反应的平衡常数K=6.25 | |
| C. | 当容器中气体密度不再变化时,该反应达到平衡状态 | |
| D. | t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-+H2O?CH3COOH+OH- | B. | Al3++H2O?Al(OH)3+H+ | ||
| C. | CH3COOH+NaOH?CH3COONa+H2O | D. | NaCl+H2O?NaOH+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H8 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
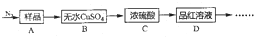
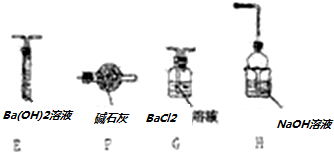
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,减小水蒸气的浓度,正反应速率增大,逆反应速率减小 | |
| D. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 | |
| D. | 下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com