
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
| A | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
| B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
| C | NaCl(s) | KNO3(s) | AgNO3溶液 | 过滤 |
| D | Cu(s) | Ag(s) | CuSO4溶液 | 电解法 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二者都与饱和Na2CO3溶液反应;
B.NaOH与NH4Cl、Fe3+均反应;
C.氯化钠与硝酸银溶液反应;
D.可用银做阳极,电解硫酸铜溶液除杂.
解答 解:A.二者都与饱和Na2CO3溶液反应,应用饱和碳酸氢钠溶液除杂,故A错误;
B.NaOH与NH4Cl、Fe3+均反应,可加入氢氧化铁,调节溶液的pH,使铁离子水解而除去,故B错误;
C.氯化钠与硝酸银溶液反应,不能除去杂质,故C错误;
D.可用银做阳极,电解硫酸铜溶液,阴极可析出铜,可用于除杂,故D正确.
故选D.
点评 本题考查物质分离提纯的方法及选择,为高频考点,把握物质的性质及常见的混合物分离方法为解答的关键,注意除杂的原则,题目难度不大.


科目:高中化学 来源: 题型:选择题
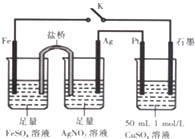
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 导线中流过0.2mol电子时,加入4.9gCu(OH)2,CuSO4溶液可恢复原组成 | |
| C. | 闭合K,石墨电极上只生成铜 | |
| D. | 闭合K,外电路电流方向为Fe电极→石墨电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) | |
| B. | 10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(Clˉ)>c(OHˉ)>c(H+) | |
| C. | 10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) | |
| D. | 10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合 c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 溶液的H+浓度变化:①增大,②减小 | |
| D. | 电极反应式①中阳极:4OH--4e-═2H2O+O2↑,②中负极:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24.5L氢气中所含氢原子数一定大于2NA | |
| B. | 1molCH3+电子数为9NA | |
| C. | 100g 60%CH3COOH水溶液中含有的分子数为NA | |
| D. | 常温常压下0.1mol CO和NO的混合气体含氧原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,通过电解原理来降解酸性废水中的NO3-,下列说法错误的是( )
以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,通过电解原理来降解酸性废水中的NO3-,下列说法错误的是( )| A. | 该新型电池工作时,负极的电极反应式是Al+4OH--3e-═AlO2-+2H2O | |
| B. | 为增强溶液的导电性,I区水中可加入少量Na2SO4 | |
| C. | A为电源正极,H+从Ⅰ区移向Ⅱ区 | |
| D. | 阴极反应式为:2NO3-+6H2O+10e-═N2↑+12OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B和C可能都是液体酶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com