
2013年雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP=-???????????????? 。
②该反应在低温下能自发进行,该反应的ΔH ????????? 0。(选填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2 --tl=t3-t2)。

则下列说法不正确的是????????? 。(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用、使用清洁能源等有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
①
②
③
①△H3和△H1、△H2的关系为△H3=???????????? 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在图中画出tl时刻后H2的体积分数变化趋势曲线。

③甲醇汽油可’以减少汽车尾气对环境的污染。
某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)  CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)??????? ? v(逆)(选填‘‘>”、“<’’或“=”),判断的理由??????? 。
(1)①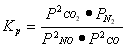 ??? ②<?? ③D
??? ②<?? ③D
(2) ①ΔH3=ΔH1+ΔH2。
②如图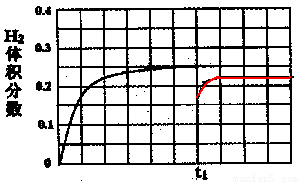
(起点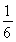 ,画在0.15到0.2之间,终点
,画在0.15到0.2之间,终点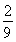 ,不高于原平衡线都正确)
,不高于原平衡线都正确)
③=。温度不变K不变,加入3molCO后容器体积变为6L,经计算Qc=K=9,所以平衡不移动。
【解析】
试题分析:(1) ①对于在一定体积的密闭容器内发生的有气体参加的反应来说,气体的物质的量的比等于压强之比。所以当反应达到平衡后,平衡时生成物各组分的压强幂指数的乘积与反应物各组分的压强幂指数的乘积的比。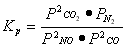 。②放热反应和体系混乱程度增大的反应是自发进行的反应。对于反应2NO(g)+2CO
。②放热反应和体系混乱程度增大的反应是自发进行的反应。对于反应2NO(g)+2CO 2CO2(g)+N2(g)是混乱程度减小的反应,要使反应在低温下能自发进行,则该反应的ΔH<0. ③A.由于该反应的正反应为放热反应。所以随着反应的进行,体系的温度不断升高,正反应速率不断加快。有更多的反应物变为生成物,所以逆反应速率也不断加快。若反应达到平衡。由于该反应的正反应为放热反应,所以升高温度,平衡向逆反应方向移动。V正应该减小。但在c点未看到速率减小的趋势,所以未达到平衡状态。正确。B.由速率图像可以看出:反应速率a点小于b点。正确。C.由图像可以看出:在从开始到t3以前,V正在不断的增大,反应正向进行。反应未达到平衡状态。因为反应是从正反应方向开始的,所以反应物浓度a点大于b点。正确。:D. 因为t2 --tl=t3-t2,速率不断加快,单位时间内物质改变的浓度大,所以反应物的转化率NO的转化率:t2~t3 > tl~t2。错误。(2)①? ①+②整理可得
2CO2(g)+N2(g)是混乱程度减小的反应,要使反应在低温下能自发进行,则该反应的ΔH<0. ③A.由于该反应的正反应为放热反应。所以随着反应的进行,体系的温度不断升高,正反应速率不断加快。有更多的反应物变为生成物,所以逆反应速率也不断加快。若反应达到平衡。由于该反应的正反应为放热反应,所以升高温度,平衡向逆反应方向移动。V正应该减小。但在c点未看到速率减小的趋势,所以未达到平衡状态。正确。B.由速率图像可以看出:反应速率a点小于b点。正确。C.由图像可以看出:在从开始到t3以前,V正在不断的增大,反应正向进行。反应未达到平衡状态。因为反应是从正反应方向开始的,所以反应物浓度a点大于b点。正确。:D. 因为t2 --tl=t3-t2,速率不断加快,单位时间内物质改变的浓度大,所以反应物的转化率NO的转化率:t2~t3 > tl~t2。错误。(2)①? ①+②整理可得 ΔH3=ΔH1+ΔH2。②由于温度不变,所以化学平衡常数就不会变化。
ΔH3=ΔH1+ΔH2。②由于温度不变,所以化学平衡常数就不会变化。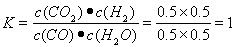 在加入1 mol H2O(g)的一瞬间,H2的物质的量没变,所以H2的体积分数为0.5÷3=
在加入1 mol H2O(g)的一瞬间,H2的物质的量没变,所以H2的体积分数为0.5÷3=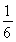 .由于增大反应物的浓度,化学平衡正向移动,会产生更多的H2,因此H2的体积分数不断增大。假如c(CO)改变浓度为x,则再次达到平衡时c(CO)=0.5-x;c(H2O)=1.5-x;c(CO2)= 0.5+x ; c(H2)= 0.5+x. (0.5-x )×(1.5-x)= (0.5+x )×(0.5+x).解得
.由于增大反应物的浓度,化学平衡正向移动,会产生更多的H2,因此H2的体积分数不断增大。假如c(CO)改变浓度为x,则再次达到平衡时c(CO)=0.5-x;c(H2O)=1.5-x;c(CO2)= 0.5+x ; c(H2)= 0.5+x. (0.5-x )×(1.5-x)= (0.5+x )×(0.5+x).解得 此时H2的体积分数为(1/6+0.5)÷3=2/9.图像见答案。③恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)
此时H2的体积分数为(1/6+0.5)÷3=2/9.图像见答案。③恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)  CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L, 现往容器中继续通人3 mol CO,温度不变K不变,加入3molCO后容器体积变为6L
现往容器中继续通人3 mol CO,温度不变K不变,加入3molCO后容器体积变为6L  =K。所以所以平衡不移动。v(正)= v(逆)。
=K。所以所以平衡不移动。v(正)= v(逆)。
考点:考查化学平衡状态的判断、热化学方程式的书写、生成物的体积分数与时间关系的图像的知识。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省盟校十校联考高三第一次联考理综化学试卷(解析版) 题型:填空题
Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g) +N2(g) ,在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g) +N2(g) ,在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。

据此判断:
(1)该反应的ΔH????? 0(选填“>”、“<”)。
(2)若在一定温度下,将1.0 mol NO、0.5 mol CO充入0.5 L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8 mol、0.3 mol、0.2 mol、0.1 mol,该反应的化学平衡常数为K=???????? ;若保持温度不变,再向容器中充入CO、N2各0.3 mol,平衡将????????? 移动(选填“向左”、“向右”或“不”)。
Ⅱ.以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

回答下列问题:
(1)B极为电池????? 极,电极反应式为????????????????????????????????????? 。
(2)若用该燃料电池做电源,用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为???????? (标况下)。
Ⅲ.FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为?????? 。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为?????? 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省宁波市高三上学期期末考试化学试卷(解析版) 题型:填空题
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO
(g)  2CO2 (g) +N2 (g) 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g) 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
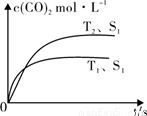
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化 学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
① 煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污
染。
CH4(g)+2NO2(g)
= N2(g)+CO2(g)+2H2O(g) 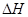 =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g) 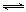 N2O4(g)
N2O4(g)
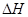 =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
② 将燃煤产生的二氧化碳回收利用,可 达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a) 。
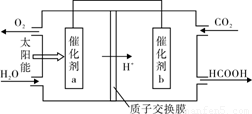
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省开封市高三第二次质量检测理综化学试卷(解析版) 题型:选择题
2013年元月,包括开封在内的多个地区发生持续雾霾天气,“PM2.5”数据监测纳入公众视野。PM2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺的有害颗粒。下列有关说法中不正确的是
A.PM2.5在空气中形成了气溶胶
B.PM2.5表面积大能吸附大量的有毒、有害物质
C.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
D.PM2.5主要来自工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com