
【题目】A、B、C为短周期元素,在周期表中所处的相对位置如图所示,B的气态氢化物是工业上合成硝酸的重要原料。下列有关说法正确的是

A. B和C两原子间可以形成离子键
B. A的氧化物电子式为![]()
C. 原子半径:A>B>C
D. 最高价氧化物对应的水化物的酸性:B>A
【答案】D
【解析】
依题意,A、B、C为短周期元素,B的气态氢化物是工业上合成硝酸的重要原料,则B为N元素,从A、B、C的相对位置看,A为Si元素、C为S元素。
A项、N元素和S元素均为非金属元素,两原子间不可能形成离子键,故A错误;
B项、A的氧化物是二氧化硅,二氧化硅固体中不存在“SiO2”分子,其基本结构是“SiO4”四面体,每个硅原子与周围4个氧原子形成共价键,晶体中只有单键、没有双键,故B错误;
C项、一般而言,电子层数越大,原子半径越大,则Si原子的原子半径最大;又同周期元素从左到右,原子半径依次减小,原子半径的大小顺序为Si>S;N和S既不是同周期也不是同主族,无法比较两者的原子半径,故C错误;
D项、同周期元素,从左到右非金属性依次增强,同主族元素,从上到下非金属性依次减弱,则非金属性的强弱顺序为N >P>Si,故最高价氧化物对应的水化物的酸性HNO3>H2SiO3,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A. 0.2mol/L的NaHCO3溶液中: c(Na+)>c(HCO3-)>c(OH-)>c(H+)
B. 叠氮酸(HN3)与醋酸酸性相近,0.1mol/LNaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
C. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-)
D. 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)= c(HC2O4-)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇(可逆反应),这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式______________________________________________。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是________。
a.体系压强不再改变
b.H2的浓度不再改变
c.气体的密度不随时间改变
d.单位时间内消耗H2和CO2的物质的量之比为3:1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。

根据图中数据
①降低温度,平衡向________方向移动。
②在700 K、起始投料比![]() =1.5时,H2的转化率为________。
=1.5时,H2的转化率为________。
③在500 K、起始投料比![]() =2时,达到平衡后H2的浓度为a mol·L-1,则达到平衡时CH3CH2OH的浓度为________。
=2时,达到平衡后H2的浓度为a mol·L-1,则达到平衡时CH3CH2OH的浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() (△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
⑴反应的化学方程式中a∶b∶c为;
⑵A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为;
⑶B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是,其值是;
⑷由第一次平衡到第二次平衡,平衡移动的方向是,采取的措施是;
⑸比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低;T2T3(填“<”“>”“=”)判断的理由是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的叙述中不正确的是( )
A. 苯与少量溴水混合,充分振荡、静置后,上层液体为橙红色,下层液体接近无色
B. (CH3)3CCH2Br在NaOH的醇溶液中加热不能发生消去反应
C. 乙烯、乙炔、聚乙烯 均能使溴水褪色
D. 等质量的C2H4、聚乙烯(![]() 分别完全燃烧,消耗O2的物质的量相同
分别完全燃烧,消耗O2的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化亚铜(CuⅠ)是阳极射线管覆盖物,不溶于水和乙醇。下图是工业上由冰铜制取无水碘化亚铜的流程。

(1)FeS中S的化合价为_____________。
(2)步骤①中Cu2S被转化为Cu,同时有大气污染物A生成,相关化学反应方程式为_____________,熔渣B的主要成分为黑色磁性物质,其化学式为_____________。
(3)步骤②中H2O2的作用是_____________;步骤③中加入过量NaI涉及的主要离子反应方程式为_____________。
(4)步骤④用乙醇洗涤的优点是_____________;检验沉淀是否洗涤干净的方法是_____________。
(5)溶液I中通常含少量Fe(Ⅲ)。已知该工业条件下,Fe(OH)3的Ksp=1.0×10-38,据此分析除去Fe(Ⅲ)(即c(Fe3+)≤1.0×10-5mol/L)应调节pH不小于_____________(水的离子积以常温计)。
(6)准确称取 m g CuI样品,加入足量的Fe2(SO4)3溶液,发生反应为2CuⅠ+4Fe3+===2Cu2++4Fe2++I2,待样品完全反应后,用amol/L酸性KMnO4溶液滴定Fe(Ⅱ),消耗标准液的体积平均值为ⅴmL。样品中CuI的质量分数的计算表达式为_____________;如果滴定前,酸式滴定管没有用标准液润洗,CuI的质量分数_____________(填“偏低”、“偏高”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物“利尿酸”是一种常见的兴奋剂,其分子结构如下图,下列说法正确的是
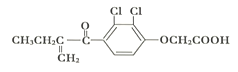
A. 利尿酸是芳香烃
B. 利尿酸与AgNO3溶液反应有白色沉淀生成
C. 一定条件下,利尿酸能发生取代反应、加成反应和酯化反应
D. 1mol利尿酸与饱和碳酸钠溶液反应能放出1 mol CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com