
分析 (1)双氧水中氧元素化合价降低作氧化剂,Fe2+化合价升高做还原剂,根据得失电子守恒判断;
(2)NaH与BCl3反应制得NaBH4和NaCl;
(3)根据NaBH4+2H2O=NaBO2+4H2↑中NaBH4的H化合价由-1升高到0价计算;
(4)NaH与CuS反应,NaH具有还原性,据此分析判断;
(5)因为盐酸具有挥发性,所以金属钠可能与盐酸反应生成NaCl.
解答 解:(1)为除去酸性溶液中的Fe2+,常常向酸性溶液中加入双氧水,使Fe2+氧化为Fe3+,双氧水中氧元素化合价降低作氧化剂,Fe2+化合价升高做还原剂,根据得失电子守恒,氧化剂与还原剂的物质的量之比1:2;故答案为:1:2;
(2)NaH与BCl3反应制得NaBH4和NaCl,反应方程式为:4NaH+BCl3=NaBH4+3NaCl,故答案为:4NaH+BCl3=NaBH4+3NaCl;
(3)由NaBH4+2H2O=NaBO2+4H2↑反应中NaBH4的H化合价由-1升高到0价,所以1molNaBH4与足量水反应,转移电子的物质的量为1mol×4×(1-0)=4mol;故答案为:4;
(4)NaH与CuS反应,NaH具有还原性,则将CuS还原成Cu,NaH本身被氧化成氢气,所以脱斑过程中发生反应的产物为Na2S、H2、Cu;故答案为:Na2S、H2、Cu;
(5)因为盐酸具有挥发性,所以金属钠可能与盐酸反应生成NaCl,则该氢化钠样品中所含的杂质可能是NaCl,故答案为:NaCl.
点评 本题考查氧化还原反应的相关知识,为高频考点,把握反应前后化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
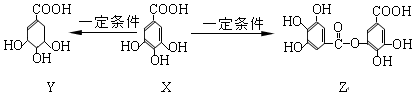
| A. | 1molZ最多能与7molNaOH发生反应 | |
| B. | 1molX最多能与2molBr2发生取代反应 | |
| C. | Y分子结构中有3个手性碳原子 | |
| D. | Y能发生加成、取代、消去、氧化、缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水库的钢闸门接直流电源的正极,可以减缓闸门的腐蚀 | |
| B. | 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用 | |
| C. | H2O2分解产生标准状况下22.4 L O2,理论上转移电子数约为4×6.02×1023 | |
| D. | 常温下pH=3的盐酸与pH=11的某碱溶液等体积混合,若溶液呈碱性,该碱为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈 | |
| B. | 室温下向1LpH=2的醋酸溶液中加水,所得溶液中H+数目减少,酸性减弱 | |
| C. | 水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1醋酸 | B. | 1L0.1mol•L-1H2SO4溶液 | ||
| C. | 0.5L0.1mol•L-1盐酸 | D. | 2L0.1mol•L-1NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液,再加稀HNO3 | 生成白色沉淀,且沉淀不溶解 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、K+ |
| D | 滴加NaOH溶液加热,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| T |
| A. | Y的最高价氧化物的水化物具有两性 | |
| B. | Z的最高价氧化物常温常压下为固体 | |
| C. | 气态氢化物的稳定性:X>W>Z | |
| D. | 原子半径:W>Z>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com