
| A. | 1 mol强酸和1 mol强碱完全反应所放出的热量称为中和热 | |
| B. | 热化学方程式中表明的热量是指每摩尔反应物反应时吸收或放出的热量 | |
| C. | 1 mol碳燃烧所放出的热量为燃烧热 | |
| D. | 热化学方程式中的化学计量数表示物质的量,因此可用分数表示 |
分析 A、中和热是指稀的强酸和稀的强碱发生反应生成1mol水放出的热量;
B、热化学方程式中物质的计量数不一定为1;
C、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量;
D、热化学方程式中的化学计量数只表示物质的量,不表示分子数.
解答 解:A、在稀溶液中,稀的强酸跟强碱发生中和反应而生成1mo水,这时的反应热叫做中和热,如1 mol强酸和1 mol强碱完全反应所放出的热量不一定等于中和热,如1mol硫酸与1mol氢氧化钡反应生成2mol水,反应热不是中和热,故A错误;
B、热化学方程式中物质的计量数不一定为1,热化学方程式中表明的热量不是指每摩尔反应物反应时吸收或放出的热量,故B错误;
C、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1 mol碳完全燃烧生成二氧化碳时所放出的热量为燃烧热,故C错误;
D、热化学方程式中的化学计量数只表示物质的量,不表示分子数,所以可用分数或小数表示,故D正确;
故选D.
点评 本题考查了热化学方程式的含义、燃烧热和中和热的概念,题目难度不大,侧重于基础知识的考查.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲醛可作食品防腐剂 | B. | 氢氧化铝可作抗酸药 | ||
| C. | 氯化钠可作食品调味剂 | D. | 生石灰可作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:乙二醇>乙醇>苯酚 | |
| B. | 用质谱法可确定有机物分子中的官能团 | |
| C. | 用核磁共振氢谱能够区分CH3CH2CHO和CH3COCH3 | |
| D. | 乙二酸、甲醛、苯乙烯均可发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2mol | B. | 0.6mol | C. | 0.8mol | D. | l.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
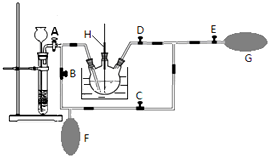
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
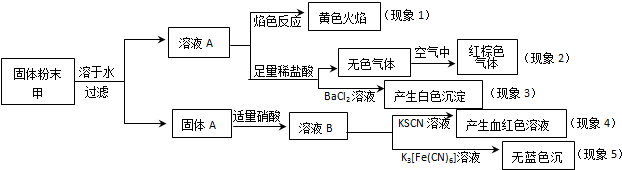
| A. | 根据现象1可推出该固体粉末中含有钠元素,但一定不含钾元素 | |
| B. | 根据现象2可推出该固体粉末中一定不含有NaNO2 | |
| C. | 根据现象3可推出该固体粉末中一定含有Na2SO4 | |
| D. | 根据现象4和现象5可推出该固体粉末中一定不含FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
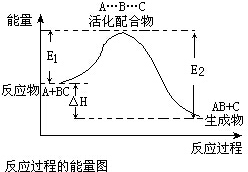
| A. | 反应物的键能总和比生成物的键能总和高 | |
| B. | E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 | |
| C. | 正反应的热效应为△H=E1-E2,且E2>E1,所以正反应为放热反应 | |
| D. | 使用合适的催化剂能同时降低E1和E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | =196.64kJ | B. | =98.32kJ | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com