
【题目】某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,设计如下实验方案:
(方案1)称取一定质量的纯碱样品(已知锥形瓶和硫酸溶液的质量190.720 g),利用左图装置测定纯碱样品的纯度,每隔相同时间读得电子天平的数据如表:
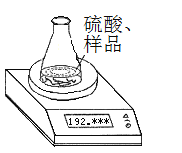
读数次数 | 质量(g) | |
锥形瓶+硫酸+试样 | 第1次 | 192.955 |
第2次 | 192.764 | |
第3次 | 192.328 | |
第4次 | 192.075 | |
第5次 | 192.075 |
(1)计算纯碱样品的纯度时,必需的数据是_____________________________(填具体数据)。不必作第6次读数的原因是________________________________________________。
(2)计算纯碱样品的纯度为_________________________(保留小数后两位)。
(方案2)测定上述样品(1.15 g)中,Na2CO3质量分数的另一种方案,其操作流程如下:
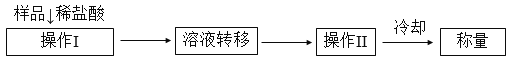
(1)溶液转移至__________(填写仪器名称),操作II的名称是______________。
(2)需直接测定的物理量是____________________。
(3)测定过程中需要的仪器有电子天平.蒸发皿、酒精灯、还需要__________、__________(固定、夹持仪器除外)。
(4)在转移溶液时,如溶液转移不完全,则Na2CO3质量分数的测定结果__________(填“偏小”、“偏大”或“不变”)
(方案3)实验装置如图:
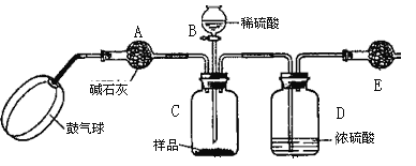
实验步骤:
①如图连接装置并加入所需药品。
②称量并记录E的质量m1(称量时注意封闭E的两端)。
③按动鼓气球,持续约1分钟。
④连接上E。
⑤打开分液漏斗B的活塞,将稀硫酸快速加入C中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录E的质量m2(称量时注意封闭E的两端及D右端的出口)。
⑧重复步骤⑥和⑦的操作,直到球形干燥管的质量基本不变,记为m3。
⑨计算。
请填空和回答问题:
(1)C中发生反应的离子方程式为:______________________________________。B仪器的名称为__________。如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果将__________(填“偏高”、“偏低”或“不变”)。
(2)浓硫酸的作用是_________________,若没有D,则实验结果__________(填“偏高”、“偏低”或“无影响”)。
(3)步骤③和⑥的作用是____________________,____________________。鼓气球的速度是快速好,还是缓慢鼓入?为什么?__________________________________________。
(4)E装置的固体试剂为__________(填编号)
A.碱石灰 B.无水氯化钙 C.浓硫酸 D.生石灰
(5)步骤⑧的目的是________________________________________________。
(6)试样中纯碱样品的质量分数计算式为_____________________________________。
(7)本实验设计中若有需要改进的地方,请指出该进之处并说明原因。
_______________________________________________________________________。
(8)实验还可以用其它定量实验方法测定试样中纯碱的质量分数,请简述一种不同的定量实验方法。___________________________________________________________ 。
【答案】192.955 g,192.075 g 第4次和第5次的数据相同,说明反应已完全进行 94.85% 蒸发皿 蒸发浓缩 冷却后,氯化钠的质量 玻璃棒 烧杯 偏大 ![]() 分液漏斗 偏高 吸收水蒸气 偏高 排出装置内的CO2 将装置内的CO2出,使其充分被E吸收 缓慢鼓入;速度快速的话,会使得部分CO2残留在装置内,无法吹出。 A 确保CO2被E吸收完全
分液漏斗 偏高 吸收水蒸气 偏高 排出装置内的CO2 将装置内的CO2出,使其充分被E吸收 缓慢鼓入;速度快速的话,会使得部分CO2残留在装置内,无法吹出。 A 确保CO2被E吸收完全 ![]() ×100% 有;在E的右端再连接一个相同的干燥装置 ①取m1 g样品,溶于水中; ②加入过量的BaCl2溶液;③过滤,洗涤,烘干,称重,记为m2 g;④计算。
×100% 有;在E的右端再连接一个相同的干燥装置 ①取m1 g样品,溶于水中; ②加入过量的BaCl2溶液;③过滤,洗涤,烘干,称重,记为m2 g;④计算。
【解析】
某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,方案一根据碳酸钠和盐酸反应产生二氧化碳,气体散失后溶液质量发生变化,通过气体质量计算碳酸钠质量;方案二,反应后干燥蒸发,通过方程计算碳酸钠含量;方案三,用碱石灰吸收产生的二氧化碳,通过E增重计算碳酸钠的量。
方案一:(1)计算纯碱样品的纯度时,必需的数据是反应前的质量和反应终点时的质量,即192.955 g,192.075 g。不必作第6次读数的原因是第4次和第5次的数据相同,说明反应已完全进行;
(2)![]() ,纯碱样品的纯度
,纯碱样品的纯度![]() ;
;
方案二(1)溶液转移至蒸发皿,操作II的名称是蒸发浓缩;
(2)需直接测定的物理量是冷却后,氯化钠的质量。
(3)测定过程中需要的仪器有电子天平.蒸发皿、酒精灯、还需要玻璃棒、烧杯;
(4)在转移溶液时,如溶液转移不完全,干燥后质量偏小,则Na2CO3质量分数的测定结果偏大;
方案3(1)C中发生反应是你碳酸钠和硫酸,离子方程式为:![]() 。B仪器的名称为分液漏斗。如果将分液漏斗中的硫酸换成浓度相同的盐酸,盐酸会部分挥发,进去碱石灰,测试的结果将偏高;
。B仪器的名称为分液漏斗。如果将分液漏斗中的硫酸换成浓度相同的盐酸,盐酸会部分挥发,进去碱石灰,测试的结果将偏高;
(2)浓硫酸具有吸水性,作用是吸收水蒸气,若没有D,碱石灰将吸收多余的水,则实验结果偏高;
(3)步骤③和⑥的作用是排出装置内的CO2,将装置内的CO2出,使其充分被E吸收。缓慢鼓入;速度快速的话,会使得部分CO2残留在装置内,无法吹出。
(4)E装置的固体试剂为碱石灰,无水氯化钙、浓硫酸和生石灰只能吸收水。
(5)步骤⑧反复操作,目的是确保CO2被E吸收完全。
(6)试样中纯碱样品的质量分数计算式为![]() ×100%。
×100%。
(7)装置E吸收反应产生的二氧化碳,但是与空气直接接触容易导致误差偏大,故有问题,应在E的右端再连接一个相同的干燥装置。
(8)实验还可以用沉淀法计算碳酸根质量,进而计算碳酸钠质量。①取m1 g样品,溶于水中; ②加入过量的BaCl2溶液;③过滤,洗涤,烘干,称重,记为m2 g;④计算。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】实验室以电石主要成分是CaC2)为原料制备乙炔,装置如图所示:
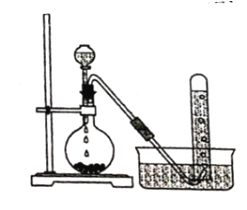
(1)实验室制取乙炔的化学方程式为 ______________。
(2)为除去乙炔中混有的少量硫化氢杂质,可将气体通过 ____________ (选填编号)。
a.酸性KMnO4溶液 b.CCl4 c.NaOH溶液
(3)氧炔焰是乙炔在氧气中燃烧的高温火焰,可用于______________________ 。
(4)乙炔在一定条件下三聚得到CH2=CHC≡CCH=CH2,写出与该三聚物具有相同化学式且不能使溴的CCl4溶液褪色和酸性高锰酸钾溶液褪色的物质的结构简式_________
(5)乙炔聚合得到聚乙炔,聚乙炔__________导电(选填“能”或“不能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.甲醇是一种常见的醇,俗称木精或木醇
B.沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
C.钠融法可以测定有机物的结构
D.木糖醇( ![]() )和葡萄糖互为同系物,均属于糖类
)和葡萄糖互为同系物,均属于糖类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠和水混合反应来制备溴乙烷,并探究溴乙烷的性质。有关数据见下表:
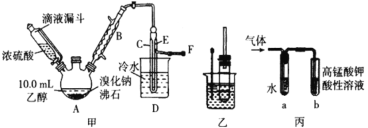
I. 溴乙烷的制备
反应原理如下,实验装置如上图(加热装置、夹持装置均省略):
H2SO4+NaBr ![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(1) 图甲中A 仪器的名称_____,图中B 冷凝管的作用为_____。
(2) 若图甲中A 加热温度过高或浓硫酸的浓度过大,均会使 C 中收集到的粗产品呈橙色,原因是A 中发生了副反应生成了_____;F 连接导管通入稀NaOH 溶液中,其目的主要是吸收_____等尾气防止污染空气
II. 溴乙烷性质的探究
用如图实验装置验证溴乙烷的性质:
(3) 在乙中试管内加入 10mL6mol·L -1NaOH 溶液和 2mL 溴乙烷,振荡、静置,液体分层,水浴加热。该过程中的化学方程式为_______。
(4) 若将乙中试管里的 NaOH 溶液换成NaOH 乙醇溶液,为证明产物为乙烯,将生成的气体通入如图丙装置。a 试管中的水的作用是_______;若无 a 试管,将生成的气体直接通入 b 试管中,则 b中的试剂可以为 _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了验证难溶的氯化银在水中也存在溶解平衡,设计了如下实验方案:( )
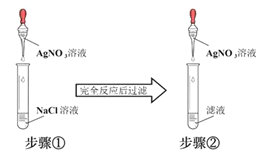
A.步骤①中应加入过量的AgNO3溶液
B.步骤①中应使NaCl溶液过量
C.步骤②中现象是无沉淀产生
D.步骤②中选用的AgNO3溶液浓度应小于步骤①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是
A.XY晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m![]() 6
6
C.X、Y可以属于同一周期,也可居于两个不同周期
D.X与Y一定不属于同一主族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱工业始于 18 世纪末,至今已有两百多年。在纯碱工业史上,比利时人索尔维,中国人侯德榜等都作出了突出的贡献。据此完成下面小题。
【1】下图是1861年索尔维发明的制碱法中物质转化关系图,其中I~IV代表四个主要化学反应,a~i代表除H2O以外不同的物质。若不计其他损耗,,下列说法正确的是( )
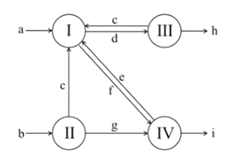
A.水溶液呈碱性的物质只有e、g、h
B.水溶液呈酸性的物质只有c、f、i
C.每消耗1mol a,同时消耗0.5mol b
D.每消耗1mol h,同时消耗0.5mol i
【2】从母液中析出的NaHCO3中含有NH4Cl,需洗涤后再进行灼烧。若省略洗涤操作,则最终对所得纯碱纯度影响叙述正确的是( )
A.无明显影响B.NH4Cl杂质含量上升
C.NaCl杂质含量上升D.NaOH杂质含量上升
【3】化工专家侯德榜发明的"侯氏制碱法"大大推进了纯碱工业的发展,其最重要贡献是( )
A.找到了新型高效的催化剂B.充分利用了能量
C.提高了纯碱产品的纯度D.提升了Na+的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了约翰·班尼斯特·古迪纳夫、迈克尔·斯坦利·惠廷汉姆和吉野彰,以表彰他们对锂离子电池研发的贡献。目前最安全的锂离子电池是LiFePO4电池,结构如图所示,电池中间是聚合物的隔膜,只允许Li+通过。
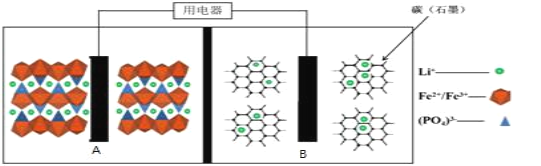
原理如下:(1-x)LiFePO4+xFePO4+LixCn![]() LiFePO4+nC。
LiFePO4+nC。
下列说法不正确的是( )
A.放电时,B电极发生氧化反应
B.放电时,导线转移1mol电子,B电极室质量减少7xg
C.充电时,A极电极反应式:xLiFePO4-xe-=xFePO4+xLi+
D.充电时,Li+从A电极室向B电极室移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CF3COOH水溶液中将甲烷直接转化为CH3OH的反应机理如图,下列说法正确的是
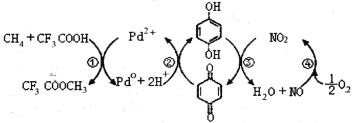
A.所含部分元素第一电离能:C<N<O<F
B.反应③的氧化剂为对苯二酚
C.此法由甲烷制取甲醇的方程式为:2CH4+O2 2CH3OH
2CH3OH
D.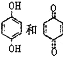 均可以与浓溴水反应,且反应类型相同
均可以与浓溴水反应,且反应类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com