


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |
| 浓H2SO4 |
| △ |
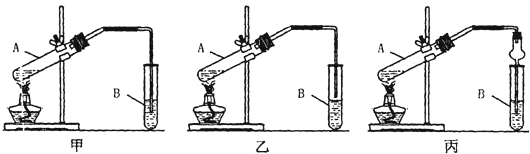
查看答案和解析>>
科目:高中化学 来源: 题型:
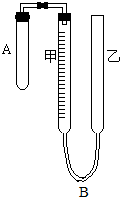 为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.
为了测定气体摩尔体积,用如图所示的装置和下列实验药品:将一定量锌片与足量的稀硫酸在试管A中反应,量气管B是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装适量水,甲管有刻度,甲、乙管可固定在铁架台上,供量气用,乙管可上下移动,以调节液面高低.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
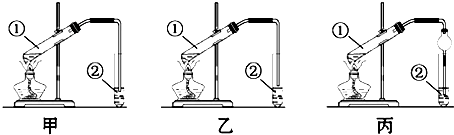
查看答案和解析>>
科目:高中化学 来源:2014届湖北省、黄石二中、鄂州高中高三11月联考化学试卷(解析版) 题型:实验题
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:

|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式:
|
|
c |
|
棉球变为白色 |
结论:该气体具有 性 |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。
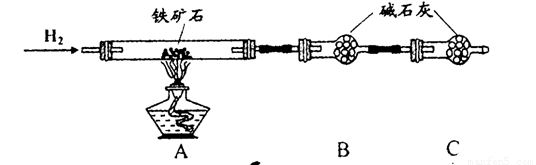
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)步骤c中填空
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。实验二:铁矿石中含铁量的测定
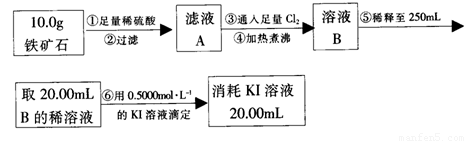
(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤②和⑤中都要用到的玻璃仪器是______ __。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成
(6)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com