
| A. | 称取1.06 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 | |
| B. | 称取1.1 g无水碳酸钠时,砝码与碳酸钠放反,所配溶液浓度偏高 | |
| C. | 转移碳酸钠溶液时,未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 取所配溶液10 mL,所取溶液中Na+浓度为0.2mol•L-1 |
分析 A.配制溶液时,固体的溶解要在烧杯中进行,不能用容量瓶溶解;
B.砝码与碳酸钠放反,质量偏小;
C.移液时用玻璃棒引流,防止液体溅出;
D.浓度与体积无关.
解答 解:A.配制溶液时,固体的溶解要在烧杯中进行,容量瓶是精密仪器,不能用容量瓶溶解,故A错误;
B.砝码与碳酸钠放反,质量偏小,浓度偏低,故B错误;
C.移液时用玻璃棒引流,防止液体溅出,否则导致浓度偏小,故C错误;
D.浓度与体积无关,0.1mol•L-1Na2CO3溶液中Na+浓度为0.2mol•L-1,故D正确.
故选D.
点评 本题考查了配制一定物质的量浓度的溶液方法及误差分析,题目难度不大,注意掌握配制一定物质的量浓度的溶液方法,明确误差分析的方法与技巧.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
B.溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
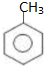
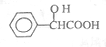 ,工业上扁桃酸可以由烃A经过以下步骤合成得到:
,工业上扁桃酸可以由烃A经过以下步骤合成得到: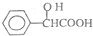
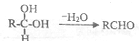
 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
.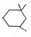 )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
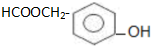 .
.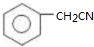 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸(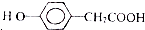 )的合理路线.
)的合理路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 OH-+H3PO4
OH-+H3PO4 CH3COO-+NH4+.
CH3COO-+NH4+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 | |
| B. | Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | Y分别与Z、W、R以两种元素组成的常见化合物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | ||
| C | D |
| A. | A、C、D的最高价氧化物对应水化物的酸性强弱顺序:D>C>A | |
| B. | B和C形成的化合物具有两性 | |
| C. | C的阳离子与B的阴离子的电子层结构不同 | |
| D. | D元素的最简单氢化物的热稳定性大于B元素的最简单氢化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com