
| A. |  | B. |  | C. | 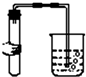 | D. |  |
分析 A.NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl;
B.给试管内液体加热,液体不可超过试管容积的三分之一,并且用外焰加热;
C.化学实验装置的气密性检验的原理是使装置内外的压强不相等,基本方法是观察气泡或液面变化;
D.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散.
解答 解:A.NH4Cl固体受热分解生成NH3和HCl,而当温度降低时,NH3和HCl又重新化合成固体NH4Cl,气体进入干燥管的机会不多,故A错误;
B.给试管内液体加热,液体不可超过试管容积的三分之一;并且需要用酒精灯火焰的外焰加热,故B错误;
C.该装置检查装置气密性的方法是:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确,故C正确;
D.稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散,一定不能把水注入浓硫酸中,因为浓硫酸是一种无色油状液体,因为浓硫酸的密度比水的大,它溶解于水还会放出大量的热,稀释时如把水倒入浓硫酸中,水会浮在浓硫酸上面,且浓硫酸溶于水会放出大量的热水会沸腾会造成酸液飞溅产生危险,图中所示操作错误,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类题的关键.


科目:高中化学 来源: 题型:解答题
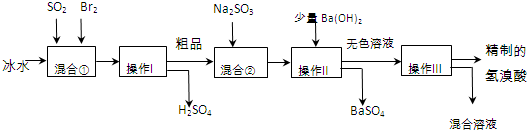
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3 | |
| B. | CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀 | |
| C. | 因为高温时发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| D. | SiO2是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.43×104 kJ | B. | 2.35×104 kJ | C. | 2.23×104 kJ | D. | 2.14×104 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6mol | B. | 10mol | C. | 3amol | D. | 3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 推广使用一次性纸杯 | |
| B. | 用天然气替代煤作燃料 | |
| C. | 开发利用太阳能 | |
| D. | 鼓励公民用私家车替代公共交通出行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com