
����Ŀ��Ϊ�ⶨij�л���A�Ľṹ����������ʵ�飮 [����ʽ��ȷ��]
��1�����л���A�����������г��ȼ�գ�ʵ���ã�����9.0g H2O��17.6g CO2 �� ��������13.44L����״���£���������ʵ����ʽ�� �� �ܷ�ݴ�ȷ�����л���ķ���ʽ��������д�������ʽ����������˵�����ɣ�
��2�����ݼۼ����ۣ�Ԥ��A���ܵĽṹ�֣������������칹����
��3��[�ṹʽ��ȷ��] ���ⶨ���л���A��������2�ֲ�ͬ��������ԭ�ӣ���A��������Ʒ�Ӧ�ų����壬��A�Ľṹ��ʽΪ ��
��4��[����ʵ��] A��һ����������ˮ������B��B�ɷ����Ӿ۷�Ӧ����C����д��Aת��ΪB�Ļ�ѧ��Ӧ����ʽ�� ��
��5�����������е��˶�Ա����Ť��ʱ����ҽ�漴�������飨�е�Ϊ12.27�棩�����˲�λ���оֲ��䶳��������ѡ��B��ijͬϵ��������Լ������ʵķ����Ʊ������飬Ҫ��ԭ��������Ϊ100%��д���Ʊ���Ӧ����ʽ�� ��
���𰸡�
��1��C4H10O��C4H10O
��2��7
��3��C��CH3��3OH
��4��C��CH3��3OH ![]() C��CH3��2=CH2��+H2O
C��CH3��2=CH2��+H2O
��5��CH2=CH2+HCl ![]() CH3CH2Cl
CH3CH2Cl
���������⣺��1��n��CO2��= ![]() =0.4 mol��n��H2O��=
=0.4 mol��n��H2O��= ![]() =0.5 mol����Ӧ������O2�����ʵ���n��O2��=
=0.5 mol����Ӧ������O2�����ʵ���n��O2��= ![]() =0.6mol�� ���л�������ԭ�����ʵ��� n��O��=0.4 mol��2+0.5 mol��1��0.6mol��2=0.1mol�����Ը�������C��H��Oԭ�ӵĸ�����Ϊ0.4 mol����0.5mol��2����0.1mol=4��10��1���ʽΪC4H10O��̼Ϊ�ļۣ���Ϊ1�ۣ���Ϊ���ۣ������ͼ���Ϊ2n+2��nΪ̼������C4H10O�������Ѿ����ͣ������ܷ�ݴ�ȷ�����л���ķ���ʽΪC4H10O��
=0.6mol�� ���л�������ԭ�����ʵ��� n��O��=0.4 mol��2+0.5 mol��1��0.6mol��2=0.1mol�����Ը�������C��H��Oԭ�ӵĸ�����Ϊ0.4 mol����0.5mol��2����0.1mol=4��10��1���ʽΪC4H10O��̼Ϊ�ļۣ���Ϊ1�ۣ���Ϊ���ۣ������ͼ���Ϊ2n+2��nΪ̼������C4H10O�������Ѿ����ͣ������ܷ�ݴ�ȷ�����л���ķ���ʽΪC4H10O��
���Դ��ǣ�C4H10O��C4H10O����2���л���A�ķ���ʽΪC4H10O������Ϊ�ѣ�Ҳ����Ϊ����
��Ϊ�ѣ�������CH3OCH2CH2CH3��CH3OCH��CH3��2��CH3CH2OCH2CH3 ��
��Ϊ����һ�����ڱ���һԪ����
������C4H9���ܵĽṹ�У���CH2CH2CH2CH3����CH��CH3��CH2CH3����CH2CH��CH3��2����C��CH3��3 �� �����칹��Ŀ���ڶ������칹����Ŀ�����Ŀ��ܽṹ��4�֣��ֱ�Ϊ��CH3CH2CH2CH2OH��CH3CH2CH��CH3��OH����CH3��2CHCH2OH��C��CH3��3OH��
�ʷ���������ͬ���칹�干��7�֣�
���Դ��ǣ�7����3��A��������Ʒ�Ӧ�ų����壬Ϊ�����л���A��������2�ֲ�ͬ��������ԭ�ӣ�Ϊ������ԭ�ӣ����������Ĵ�ΪC��CH3��3OH��
���Դ��ǣ�C��CH3��3OH����4��C��CH3��3OH��Ũ����������·�����ȥ��Ӧ����ӦΪ��C��CH3��3OH ![]() C��CH3��2=CH2��+H2O��
C��CH3��2=CH2��+H2O��
���Դ��ǣ�C��CH3��3OH ![]() C��CH3��2=CH2��+H2O����5������ϩ�Ʊ��������ԭ����CH2=CH2+HCl
C��CH3��2=CH2��+H2O����5������ϩ�Ʊ��������ԭ����CH2=CH2+HCl ![]() CH3CH2Cl��
CH3CH2Cl��
���Դ��ǣ�CH2=CH2+HCl ![]() CH3CH2Cl��
CH3CH2Cl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾԪ�����ڱ�ǰ�����ڵ�һ���֣�����Ԫ��X��Y��Z��W��������ȷ���ǣ� ��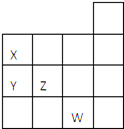
��X��Y������������ˮ��������ΪY��X
��Y��Z����̬�⻯����ȶ���Y��Z
��W�ĵ��ʳ����³�Һ̬��һ�������¿������۷�Ӧ
��W��ԭ��������Z��9
A.ֻ�Т�
B.�٢�
C.�٢ڢ�
D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŵ��Ƶõġ�ҩ�����������ƣ���������Ϊ�ǽ��ӡ���ұ�������ǣ���¯��ʯ(ZnCO3)�ͳ�ͭ��(Cu2O)�Լ�ľ̿��һ��������ϣ�������800 �����ң���������˸�Ž��Ӱ����ġ�ҩ�𡱡������й�������ȷ����(����)
�١�ҩ����ͭп�Ͻ𡡢�ұ��������¯��ʯֱ�ӱ�ľ̿��ԭ����п���ɡ����û������շ������ֻƽ�͡�ҩ�𡱡�����ϡHNO3������ƽ�͡�ҩ�𡱡��ݱ����к�ɫ��������ǡ�ҩ�𡱣���ϡ����ϴ�Ӻ��ȥ����ɫĤ����������ʾ��ͭ��ɫ
A. �٢� B. �٢ۢܢ�
C. �٢ڢۢ� D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£��ı䷴Ӧ����n(SO2���Է�Ӧ2SO2��g��+O2��g�� ![]() 2SO3��g����H<0��Ӱ����ͼ��ʾ������˵����ȷ���ǣ� ��
2SO3��g����H<0��Ӱ����ͼ��ʾ������˵����ȷ���ǣ� ��
A.��Ӧb��c���Ϊƽ��㣬a��δ��ƽ����������Ӧ�������
B.a��b��c�����ƽ�ⳣ��Kb>Kc>Ka
C.����ͼ����Եó�SO2�ĺ���Խ�ߵõ��Ļ��������SO3���������Խ��
D.a��b��c�����У�a��ʱSO2��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ���������õĦ���Fe�����ijɷ���FeO��Fe2O3����������Fe2+��Fe3+�����ʵ���֮��Ϊ1:2ʱ�����������ߣ���ʱ�������������������ԼΪ
A��70.0% B��77.8% C��72.4% D��75.0%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���Ի�ͭ��(��Ҫ�ɷ�ΪCuFeS2)Ϊԭ����ȡ���������������
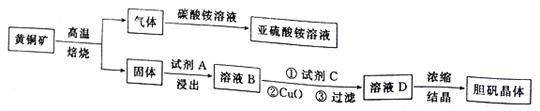
��֪��
�������±���ʱ����Ҫ��Ӧ����2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4��2FeS+3O2
2CuO+2CuSO4��2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
����������Ksp[Fe(OH)3]=8.0��10-38��Ksp[Cu(OH)2]=3.0��10-20��
��1��CuFeS2����Ԫ�صĻ��ϼ�Ϊ______________________��д����������������������淋Ļ�ѧ����ʽ��______________________________________________________________________��
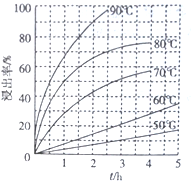
��2�����ʺϵ��Լ�A��__________��д��ѧʽ����Һ�����Լ�A��Ũ��Ϊ6.0mol��L-1ʱ ����������ʵ���У�ͭ�Ľ����ʽ������ͼ��ʾ����ͼ��֪����ͭ�Ľ�����Ϊ90% ʱ�������õ�ʵ������(�¶ȡ�ʱ��)Ϊ__________��
��3�����ʺϵ��Լ�C��__________(����)��
a��Cl2b�� H2O2 ��Һ c�����Ը��������Һ d��Ũ����
��4����������CuO��ĩ�������ǵ�����Һ��pH���ٽ�Fe3+ˮ�⣬�ﵽ���ӵ�Ŀ�ġ�д��ʵ�ָ�Ŀ�ĵ��ܷ�Ӧ�����ӷ���ʽ��_________________________________________________________��
��5����ͬѧ����CuO��һ���ܴﵽ����Ŀ�ģ���С��ͬѧȴ��Ϊ����ͨ��������ȷ��������Һ��Cu2+��Ũ��Ϊ3.0 mol��L-1����Cu2+��ʼ����ʱ��Һ��pH Ϊ__________��Fe3+������ȫʱ��Һ��pH Ϊ__________��ͨ�������жϼ���CuO__________(������������������)�ﵽĿ��(��ʾ��1g 5=0.7;ͨ����Ϊ��������Һ�е�ij����Ũ��С��1.0��10-5 mol��L-1 ʱ������Ϊ�������ѳ�����ȫ)��
��6����������ͼ�����ĵ�CuOΪag�������Ƶ�bg�������壬���Ļ�ͭ�������Ϊcg�����������������е���ʧ�����ͭ����CuFeS2����������Ϊ__________(д��ԭʼ�ļ��������ɣ����ػ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������100mL 1mol/L��������Һ���������в�����Ȼ�����ҺŨ������ȷ�ⶨ��������ʵŨ��С��1mol/L���������в�����ʹŨ��ƫ�͵�ԭ���� �� ��
������ͲȡŨ����ʱ�����Ӷ���������Ͳ��Ũ����ȫ��ת�Ƶ��ձ���ϡ�ͣ���ת�Ƶ�100mL����ƿ�У��ձ�δϴ�ӣ����ò������������ձ�����Һת��������ƿ�У�����Һ����������ƿ���棻���ý�ͷ�ιܼ�����ˮʱ��������μ��룬���ʹҺ�泬���˿̶��ߣ��������õι���ȥ�����ˮ��ʹ��Һ����պúͿ̶������С�
A. �ڢۢ� B. �ۢ�
C. �٢ڢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܹ��ɰѱ��ӡ��Ҵ�������������Һ����������Լ��ǣ� ��
A.̼������Һ
B.���Ը��������Һ
C.��̪��Һ
D.FeCl3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��һ�ֳ��õ�ȼ�ϡ�����úȼ�ղ����ķ����к���SO2��NO2��NO�ȶ����к�������̳�����Ի��������Ⱦ�������Ҫ��ú���мӹ�����ȼ�գ��������������ŷš�
(1)��úֱ�ӽ���ȼ�տ��ܻ��γ����������ꡣ
��д���й�����ת��Ϊ����Ļ�ѧ����ʽ_________________��
�������Ƕ���������������ۣ�������ȷ����________(��������)��
a��ɱ��ˮ�еĸ��������������ʳ����Դ���ƻ�ˮ����̬ϵͳ
b���Ե��ߡ����졢���������ݵȾ������������
c���ƻ������㣬���³����ն�
d�������������еĿ����ʷ�������ת��Ϊ�����Σ���ֲ���ṩ����
(2)��ͼ�Ƕ�úȼ�ղ����ķ������г����������Ļ�������ʾ��ͼ����д���ڷ��������γɸ�����Ĺ���������������Ҫ��ѧ��Ӧ�Ļ�ѧ����ʽ_______________��
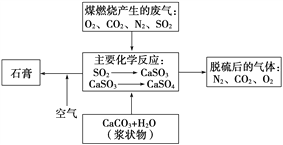
(3)�����Ժ��ڷ����к����������ӵIJ���������(д��������)________�����Ի����ĸ���Ӱ����___________________________________________��
(4)���������������Ƿ���SO2�ļ�����________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com