
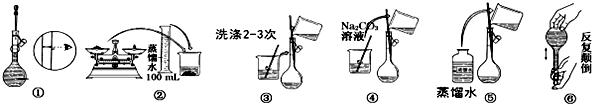
分析 (1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度;
(3)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对c(待测)的影响,以此判断浓度的误差;
(4)根据消耗盐酸的平均体积和物质的量浓度求出氢氧化钠的物质的量,再计算烧碱样品的纯度.
解答 解:(1)中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作,实验时应先称量一定质量的固体,溶解后配制成溶液,量取待测液与锥形瓶中,然后用标准液进行滴定,正确的操作步骤是C;A;B;D;E,
故答案为:C;A;B;E;
(2)滴定管0刻度在上,滴定前应调节到零刻度或零稍下的某一刻度,为减小误差,尖嘴部分应充满液体,无气泡,
故答案为:调节到零刻度或零稍下的某一刻度;
(3)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对c(待测)的影响,以此判断浓度的误差,
A.酸式滴定管未用待装溶液润洗,滴定管中溶液稀释,滴定消耗标准溶液体积增大,测定结果偏高,故A错误;
B.碱式滴定管未用待装溶液润洗,导致待测溶液浓度稀释,测定结果偏低,故B正确;
C.锥形瓶未用待装溶液润洗对测定结果无影响,故C错误;
D.在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失消耗标准溶液体积增大,测定结果偏高,故D错误;
故答案为:B;
(4)滴到消耗的硫酸为:n(硫酸)=cV=(V2-V1)×10-3L×cmol/L,根据反应方程可知,n(NaOH)=2n(硫酸)=2c(V2-V1)×10-3mol,
所以原来样品中氢氧化钠的物质的量为:2c(V2-V1)×10-3mol×$\frac{250}{25}$=2c(V2-V1)×10-2mol,
则样品中氢氧化钠的质量为m(NaOH)=nM=80c(V2-V1)×10-2g,
则该烧碱样品的纯度为:$\frac{80c({V}_{2}-{V}_{1})×1{0}^{-2}g}{mg}$×100%=$\frac{80c({V}_{2}-{V}_{1})}{m}$%;
故答案为:$\frac{80c({V}_{2}-{V}_{1})}{m}$%.
点评 本题综合考查酸碱中和滴定,侧重于化学实验基本操作以及物质的含量的测定等问题,题目难度中等,建议在学习中把握相关基本实验方法,学习中注意积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积气体所含原子个数相同 | |
| B. | 标准状况下1摩尔H2SO4的体积约为22.4 L | |
| C. | 同温同压下,相同体积的H2、O2,其质量比为1:16 | |
| D. | 1摩尔的气体只有在标准状况下才能是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | B. |  | ||
| C. |  | D. | HCl+AgNO3═AgCl↓?+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内有1mol A生成,有1molC消耗 | |
| B. | 混合气体的密度不变 | |
| C. | A的消耗速率与D的消耗速率相同 | |
| D. | 混合物的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | NO2+NO+2NaOH═2NaNO2+H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com