
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 族 |
2 | ① | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)写出元素③的离子结构示意图_________,该离子半径________S2-(填“﹥”或“﹤”) ;
(2)上述元素中最高价氧化物对应的水化物的酸性最强的是(填化学式,下同)_________;
(3)上述元素中金属性最强的是_________,写出其与水反应的化学方程式____________;
(4)由④、⑧、⑩三种元素形成的简单氢化物的沸点由高到低的顺序是_______________;
(5)②可以形成多种氧化物,其中一种是红棕色气体,试用方程式说明该气体不宜采用排水法收集的原因是______(用化学方程式来表示);标况下将一装满该气体的试管倒立于水槽中,足够时间后,水面会上升到 试管容积的________处,所得试管内溶液物质的量浓度为___________mol/L(假设溶质全部留在试管中);
(6)设计实验验证比较元素③、⑦的非金属性强弱:_________。
【答案】![]() < HClO4 K 2K +2H2O=2KOH +H2↑ HF > HBr > HCl 3NO2 + H2O = NO + 2HNO3 2/3 1/22.4 ①向硫化氢溶液中通入氧气,溶液出现浑浊,发生的反应为:2H2S+O2=2S↓+2H2O,依据氧化还原的规律可知,氧化性比较:O2>S,故可证明非金属性:O > S;②铁在硫蒸气中加热可得到硫化亚铁,而铁在氧气中点燃则得到四氧化三铁,同样与铁反应,得到的铁的价态越高,对应单质的氧化性越强,则元素非金属性越强,故可证明非金属性:O > S。
< HClO4 K 2K +2H2O=2KOH +H2↑ HF > HBr > HCl 3NO2 + H2O = NO + 2HNO3 2/3 1/22.4 ①向硫化氢溶液中通入氧气,溶液出现浑浊,发生的反应为:2H2S+O2=2S↓+2H2O,依据氧化还原的规律可知,氧化性比较:O2>S,故可证明非金属性:O > S;②铁在硫蒸气中加热可得到硫化亚铁,而铁在氧气中点燃则得到四氧化三铁,同样与铁反应,得到的铁的价态越高,对应单质的氧化性越强,则元素非金属性越强,故可证明非金属性:O > S。
【解析】
由元素在周期表中的位置可知,①为B、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br,
(1)依据满8电子稳定结构书写其离子方程式;结合简单离子半径的比较方法回答;
(2)非金属性越强,最高价氧化物对应的水化物的酸性越强;
(3)依据元素金属性的周期性变化规律作答;
(4)简单氢化物的沸点从氢键与范德华力两个因素综合考虑;
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,故二氧化氮不能用排水法收集;
(6)比较O与S的非金属性强弱,可从比较其单质的氧化性强弱考虑。
有上述分析可知,①为B、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为S、⑧为Cl、⑨为K、⑩为Br,
(1)元素③为O元素,最外层电子数为6,则其离子结构示意图为:![]() ;电子层数越大,对应简单离子半径越大,因O2-的电子层数比S2-的多,则对应的离子半径小于S2-,
;电子层数越大,对应简单离子半径越大,因O2-的电子层数比S2-的多,则对应的离子半径小于S2-,
故答案为:![]() ;<;
;<;
(2)同周期从左到右元素非金属性依次增强;同主族元素从上到下,非金属性依次减弱;且非金属性越强,对应的最高价氧化物对应的水化物中酸性越强;因F无最高价,所以酸性最强的为HClO4,
故答案为:HClO4;
(3)在元素周期表中,同周期从左到右元素金属性依次减弱,同主族元素中从上到下元素金属性依次增强,在上述元素中,金属性最强的为K,可以水反应生成相应的氢氧化物与氢气,其化学方程式为:2K +2H2O=2KOH +H2↑,
故答案为:2K +2H2O=2KOH +H2↑;
(4)④、⑧、⑩三种元素形成的简单氢化物分别为HF、HCl、HBr,因HF分子间存在氢键,则沸点最高,HBr的相对分子质量比HCl的大,则沸点从大到小依次为:HF > HBr > HCl,
故答案为:HF > HBr > HCl;
(5)该红棕色气体为二氧化氮,二氧化氮与水反应生成硝酸与NO,反应方程式为:3NO2+H2O=2HNO3+NO,故二氧化氮不能用排水法收集;依据方程式可知,气体体积减少![]() ,则标况下将一装满该气体的试管倒立于水槽中,足够时间后,水面会上升到试管容积的
,则标况下将一装满该气体的试管倒立于水槽中,足够时间后,水面会上升到试管容积的![]() 处,假设试管的体积为V,则在标砖状况下,气体的物质的量为
处,假设试管的体积为V,则在标砖状况下,气体的物质的量为![]() ,根据物质的量浓度公式可知,c=
,根据物质的量浓度公式可知,c=![]() ,
,
故答案为:3NO2+H2O=2HNO3+NO;2/3;1/22.4;
(6)依据单质的氧化性强弱来作为非金属性判断的依据之一,可设计实验如下:
①向硫化氢溶液中通入氧气,溶液出现浑浊,发生的反应为:2H2S+O2=2S↓+2H2O,依据氧化还原的规律可知,氧化性比较:O2>S,故可证明非金属性:O > S;
②铁在硫蒸气中加热可得到硫化亚铁,而铁在氧气中点燃则得到四氧化三铁,同样与铁反应,得到的铁的价态越高,对应单质的氧化性越强,则元素非金属性越强,故可证明非金属性:O > S。
答案合理可酌情给分。


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】【选修5:有机化学基础】
A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。

已知:![]() +‖
+‖![]()
![]() ;R—C≡N
;R—C≡N![]() R—COOH
R—COOH
回答下列问题:
(1)A的名称是______________,B含有的官能团的名称是________________(写名称)。
(2)C的结构简式为________________,D→E的反应类型为________。
(3)E→F的化学方程式为________________________________________。
(4)![]() 中最多有________个原子共平面。
中最多有________个原子共平面。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6∶1∶1的是_____________________(写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)。
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体A 的化学式为 NH5,已知其熔融态能够导电,则下列有关说法不正确的是( )
A. 1 mol NH5 中含有 5 NA 个 N—H 键(设 NA 表示阿伏加德罗常数的值)
B. NH5 中既有共价键又有离子键
C. NH5 的电子式为![]()
D. NH5 与水反应的离子方程式为NH4++H-+H2O===NH3·H2O+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到相应实验目的的是
选 项 | 试剂 | 实验目的 | 实验装置 | ||
X | Y | Z | |||
A | Na2SO3 | 稀HNO3 | 品红溶液 | 证明SO2具有漂白性 |
|
B | MnO2 | 浓盐酸 | KI-淀粉溶液 | 比较Cl2与I2的氧化性强弱 | |
C | Na2CO3 | 醋酸 | Na2SiO3溶液 | 证明酸性: CH3COOH > H2CO3 >H2SiO3 | |
D | 蔗糖 | 浓硫酸 | 溴水 | 证明浓硫酸具有脱水性、氧化性 | |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大。甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是

A. 甲和戊加入水中都能破坏水的电离平衡 B. 乙和戊都含有离子键
C. 原子半径r(D)>r(B)>r(C)>r(A) D. A、B、C形成的化合物一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的下列说法中不正确的是( )
A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在NaCl晶体中,每个晶胞平均占有4个Na+
C. 金属导电是因为在外加电场作用下产生自由电子
D. 铜晶体为面心立方堆积,铜原子的配位数(距离一个铜原子最近的其他铜原子的个数)为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持、加热仪器已略去,气密性已检验)。
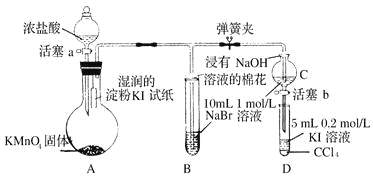
实验过程;
I.打开弹簧夹,打开活塞a,清加浓盐酸。II.当 B 和C 中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。Ⅳ……
(1)A中产生的是黄绿色气体,其离子方程式为____________,在该反应中浓盐酸表现了___________性。
(2)验证氯气的氧化性强于碘的实验现象是___________________________。
(3)B 中溶液发生反应的离子方程式是__________________________________。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________。
(5)过程Ⅲ实验的目的是__________________________。
(6)从元素周期表的递变规律的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com