
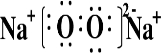 ;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.
;Na2O2与SO2反应的化学方程式为2Na2O2+2SO2═2Na2SO4.分析 (1)Na2O2为离子化合物,具有氧化物,与二氧化硫发生氧化还原反应;
(2)亚铁离子具有还原性,利用还原性检验;
(3)常温下MgO溶于蒸馏水形成的饱和液中,c(OH-)=2c(Mg2+),结合Ksp计算;
(4)阳极发生氧化反应,氧离子在阳极放电生成氧气;Al与V2O5发生铝热反应;
(5)发生反应为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
解答 解:(1)Na2O2为离子化合物,其电子式为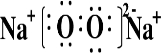 ,具有氧化物,与二氧化硫发生氧化还原反应,反应为2Na2O2+2SO2═2Na2SO4,
,具有氧化物,与二氧化硫发生氧化还原反应,反应为2Na2O2+2SO2═2Na2SO4,
故答案为: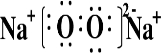 ;2Na2O2+2SO2═2Na2SO4;
;2Na2O2+2SO2═2Na2SO4;
(2)检验Fe3+中是否含有Fe2+的方法及现象为向溶液中滴入酸性KMnO4溶液,KMnO4溶液颜色褪去,说明含有亚铁离子,否则不含亚铁离子,
故答案为:向溶液中滴入酸性KMnO4溶液,KMnO4溶液颜色褪去,说明含有亚铁离子,否则不含亚铁离子;
(3)常温下MgO溶于蒸馏水形成的饱和液中,设c(OH-)为x,c(Mg2+)=0.5x,则$\frac{{x}^{3}}{4}$=5.1×10-12,解得x=2.732×10-4>1×10-7,溶液显碱性,则加酚酞变红,
故答案为:能;
(4)电解氧化铝和冰晶石的熔融液,生成铝和氧气,氧元素在阳极上被氧化,生成氧气,电极反应式为2O2--4e-=O2↑;Al与V2O5发生铝热反应为10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V,故答案为:2O2--4e-=O2↑;10Al+3V2O5$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V;
(5)Cu2(OH)2CO3可用盐酸除去,其离子反应为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,故答案为:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑.
点评 本题考查金属及化合物的综合应用,为高频考点,把握物质的性质、离子检验、Ksp计算及电解原理等为解答的关键,综合性较强,注意物质性质及反应原理的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.
某校课外活动小组利用NO2与N2O4的反应来探究温度对化学平衡的影响.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4 OH-═2 Ba SO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,100 mL 0.35 mol•L-1的KCl饱和溶液蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为4.48L(标准状况下) | |
| C. | 参加反应的金属的总质量一定是9.9g | |
| D. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
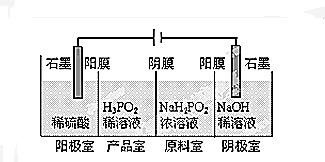
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子 | |
| C. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3 NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com