
分析 (1)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
(2)①设出达到平衡时甲醇的物质的量,然后根据达到平衡时甲醇的百分含量计算出达到平衡时各组分的物质的量及浓度,最后带人K=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$计算出该温度下该反应的平衡常数;
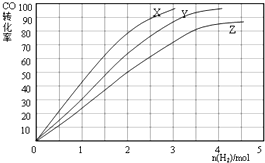
②合成甲醇是放热反应,升高温度平衡逆向移动,CO的转化率减小,则230℃时的实验结果所对应的曲线是X;
(3)①根据影响化学平衡的因素进行判断满足“平衡一定向正反应方向移动”的选项;
②原电池负极发生氧化反应,二甲醚在碱性条件下失去电子生成碳酸根离子和水,据此写出电极反应;
③根据乙醇和二甲醚中结构简式不同,发生反应时断裂的化学键不同,反应放出的能量不会相同,据此进行判断;
(4)根据lg二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ计算出1mol二甲醚完全燃烧放出的热量,然后根据热化学方程式的书写方法写出二甲醚燃烧热的热化学方程式.
解答 解:(1)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0,该反应为放热反应,升高温度,平衡向着逆向移动,可以将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC,
故答案为:加热;
(2)①按反应a充分反应达到平衡后,设n(CH3OH)=xmol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)(g)
起始量(mol) 4 12 0 0
变化量(mol) x 3x x x
平衡量(mol) 4-x 12-3x x x
达到平衡时甲醇的含量为:$\frac{x}{4-x+12-3x+x+x}$×100%=30%,
解得:x=3,达到平衡时各组分的浓度为:c(CO2)=$\frac{4-3}{2}$mol/L=0.5mol/L,c(H2)=$\frac{12-9}{2}$mol/L=1.5mol/L,c(CH3OH)=c(H2O)=$\frac{3mol}{2L}$=1.5mol/L,
则该温度下反应的平衡常数为:K=$\frac{[C{H}_{3}OH][{H}_{2}O]}{[C{O}_{2}][{H}_{2}]^{3}}$=$\frac{1.5×1.5}{0.5×1.{5}^{3}}$=$\frac{4}{3}$≈1.33,
故答案为:1.33;
②工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图.合成甲醇是放热反应,温度越低转化率越大,结合图象可知,当投入H2的物质的量相等时,从X到Z,CO的转化率在减小,说明反应逆向移动,而逆反应是吸热反应,需升高温度才能实现,230℃的实验结果所对应的曲线是X,
故答案为:X,当投入H2的物质的量相等时,从X到Z,CO的转化率在减小,说明反应逆向移动,而逆反应是吸热反应,需升高温度才能实现,故230°C为X;
(3)①A.逆反应速率先增大后减小,可以升高温度,正逆反应速率都增大,平衡向着逆向移动,满足了逆反应速率先增大后逐渐减小,故A错误;
B.正反应速率先增大后减小,说明是增大了压强或增加反应物浓度,无论改变说明条件,平衡一定向着正向移动,故B正确;
C.反应物的体积百分含量减小,如减少反应物浓度,平衡会向着逆向移动,故C错误;
D.化学平衡常数K值增大,说明生成物的浓度增大,反应物的浓度减小,平衡一定向着正向移动,故D正确;
故答案为:BD;
②二甲醚在碱性燃料电池的负极失去电子生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-═2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③化学反应实质是旧键的断裂和新键的生成,放出的能量与旧键断裂吸收的能量和新键的生成放出的能量有关,而二甲醚和乙醇分子中化学键类型不同,所以反应过程中放出的能量不同,所以C正确,
故答案为:C;
(4)1mol二甲醚的质量为46g,46g二甲醚完全燃烧生成稳定氧化物放出的热量为:31.63kJ×46g=1454.98 kJ,所以二甲醚燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol,
故答案为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
点评 本题考查了化学平衡的调控作用、化学平衡的影响因素、原电池工作原理及电极反应的书写、化学平衡常数的计算、化学平衡状态的判断等知识,题目难度较大,考查的知识点较大,充分考查了学生对化学平衡、原电池工作原理等知识的掌握情况,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2+2H2O═2Na++2OH-+H2↑ | B. | 2O22-+4H+═4OH-+O2↑ | ||
| C. | Na2O2+2H2O═2Na++2OH-+O2↑ | D. | 2Na2O2+2H2O═4Na++4OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
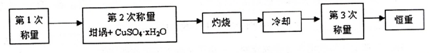

| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4,沉淀不消失 | |
| B. | 浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 | |
| C. | AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 | |
| D. | 检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  的名称为2,3-二甲基戊烷 的名称为2,3-二甲基戊烷 | |
| B. | 18.0g的葡萄糖与乳酸[CH3CH(OH)COOH]混合物完全燃烧消耗氧气13.44L | |
| C. | 结构片段为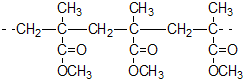 的高聚物,是通过加聚反应生成的 的高聚物,是通过加聚反应生成的 | |
| D. | 化合物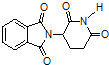 在氢氧化钠溶液中加热后有NH3生成 在氢氧化钠溶液中加热后有NH3生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每转移0.1mol电子,理论上生成20.7g Pb | |
| B. | 常温时,在正负极间接上电流表或检流计,指针不偏转 | |
| C. | 正极反应式:Pb2++2e-═Pb | |
| D. | 放电过程中,Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向某无色溶液中加入铁粉能产生大量H2,则该溶液中存在大量Na+、Ca2+、C1-、NO3- | |
| B. | 水电离出的c(H+)=1×10-3mol•L-1的水溶液中Na+、CO32-、Cl-、K+ | |
| C. | pH=1的水溶液中NH4+、Cl-、Mg2+、SO42- | |
| D. | Al3+、HCO3-、I-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol•L-1 HCN溶液的pH约为3 | |
| B. | HCN易溶于水 | |
| C. | 10 mL 1 mol•L-1 HCN溶液恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com