
 A、B、C、X均为中学化学常见物质一定条件下它们有如图转化关系(其他产物已略去).下列说法正确的是( )
A、B、C、X均为中学化学常见物质一定条件下它们有如图转化关系(其他产物已略去).下列说法正确的是( )| A、若X为Fe,则C可能为Fe(NO3 )2 |
| B、若X为KOH溶液,则A可能为Al |
| C、若X为O2,则A可为有机物乙醇,也可为非金属单质硫 |
| D、若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2 |
| X |
| X |


科目:高中化学 来源: 题型:
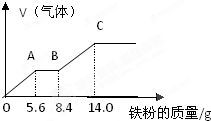 某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)
某稀硫酸和稀硝酸的混合溶液100mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸的还原产物只有NO气体)查看答案和解析>>
科目:高中化学 来源: 题型:

| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  | 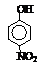 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,将22.4 L氯化氢溶于足量水中,溶液中含有的HCl分子数为NA |
| B、常温常压下,16 g 14CH4所含中子数目为8NA |
| C、常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4 NA |
| D、标准状况下,22.4 L空气含有NA个单质分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
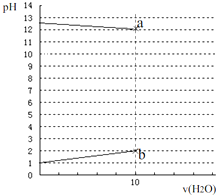 常温下,各1L的 0.1mol?L-1的HX溶液与0.1mol?L-1某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )
常温下,各1L的 0.1mol?L-1的HX溶液与0.1mol?L-1某一元碱ROH溶液加水稀释,两溶液pH与加水体积变化曲线如图,下列说法正确的是( )| A、HX为一种弱酸,ROH为弱碱 |
| B、a、b两点由水电离出c(H+)均为10-12mol?L-1 |
| C、两溶液等体积混合:c(X-)=c(R+)+c(ROH) |
| D、两溶液等体积混合:c(R+)>c(X-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有离子键的化合物一定是离子化合物 |
| B、含有共价键的化合物一定是共价化合物 |
| C、共价化合物中一定含有极性共价键,肯定不含离子键 |
| D、离子化合物一定含有离子键,可能含有共价键. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com