
| A、①②④ | B、②③⑤ |
| C、①③④ | D、①②③④⑤ |
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2 |
| B、Cl- |
| C、Fe3+ |
| D、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应中NaH作氧化剂 |
| B、该反应中水的H元素部分被氧化成氢气 |
| C、NaH溶于水后溶液显碱性 |
| D、该反应的氧化产物与还原产物质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
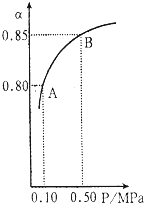 二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质.对其性质的研究是化学的重要任务.
二氧化硫和氮的氧化物是重要的化工原料,同时也是造成大气污染的主要物质.对其性质的研究是化学的重要任务.| 催化剂 |
| △ |
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| c(N2O5)/mol?L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.5NA二氧化硅约为11.2 L |
| B、向1L 1 mol/L氯化铝溶液中加入足量的氨水,生成AlO2-的个数为NA |
| C、2.7克铝与足量的氢氧化钠溶液反应,失去的电子数为0.3NA |
| D、1 mol铁与足量的氯气反应,失去的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com