
氮氧化物与悬浮在大气中的海盐粒子相互反应:
4NO2(g)+2NaCl(s)  2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
在恒温条件下,向2L恒容密闭容器中加入0.4molNO2和0.2molNaCl,10min反应达到平衡时n(NaNO3)=0.1mol。下列叙述中正确的是
A.10min内NO浓度变化表示的速率v(NO)=0.01 mol·L-1·min-1
B.若保持其他条件不变,在恒压下进行该反应,则平衡时NO2的转化率大于50%
C.若升高温度,平衡逆向移动,则该反应的△H >0
D.若起始时向容器中充入NO2(g) 0.2mol、NO(g) 0.1mol和Cl2(g) 0.1mol(固体物质足量),则反应将向逆反应方向进行
科目:高中化学 来源: 题型:
下图中A、B、C分别是三种有机物的结构模型:
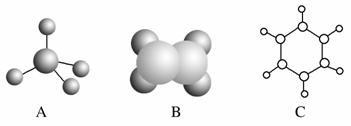
请回答下列问题:
(1)A、B两种模型分别是有机物的________模型和________模型。
(2)A及其同系物的分子式符合通式______________(用n表示)。当n=________时,烷烃开始出现同分异构体。
(3)A、B、C三种有机物中,所有原子均共面的是________(填名称)。结构简式为CH2===CH(CH2)5CH3的有机物中,处于同一平面内的碳原子数最多为________。
(4)有机物C具有的结构或性质是________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构
b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液和溴水褪色
d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成H2O和CO2,消耗氧气的体积(相同状况下)最大的是________(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的每步转化,不能通过一步反应实现的是( )
A.S→SO2→H2SO4→MgSO4 B.Si→SiO2→Na2SiO3→H2SiO3
C.Al→Al2O3→Al(OH)3→NaAlO2 D.N2→NO→NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
A.使酚酞试液变红色的溶液:Na+、Ba2+、I-、Cl-
B.使甲基橙变红色的溶液:Ca2+、K+、HCO3-、Cl-
C.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl-
D.由水电离产生的c(H+)=10-13mol·L-1的溶液:NH4+、SO42-、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素W、X、Y、Z 的原子序数依次增大,XW4分子电子总数为10,Z最外层电子数是次外层的3倍。下列说法不正确的是
A.W、X、Y、Z的原子半径大小顺序是X>Y>Z>W
B.元素Y的简单气态氢化物的热稳定性比X的强
C.含上述四种元素的化合物一定易溶于水
D.含上述四种元素的化合物可能既能与酸反应又能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
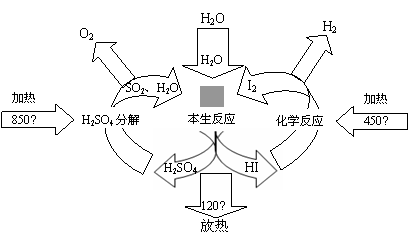 氢能是一种绿色能源,一种目前成熟的方法是利用碘硫热化学循环制备氢气,其原理示意图如下。
氢能是一种绿色能源,一种目前成熟的方法是利用碘硫热化学循环制备氢气,其原理示意图如下。
(1)已知:SO3(g)  SO2(g)+1/2O2(g) △H1 =-98.3kJ·mol-1
SO2(g)+1/2O2(g) △H1 =-98.3kJ·mol-1
H2SO4(l)  SO3(g) + H2O(l) △H2 =-130.4 kJ·mol-1
SO3(g) + H2O(l) △H2 =-130.4 kJ·mol-1
2H2SO4(l)  2SO2(g)+ O2(g)+ 2H2O(l) △H3
2SO2(g)+ O2(g)+ 2H2O(l) △H3
则△H3= kJ·mol-1 。
(2)上述热化学循环制氢要消耗大量的能量,从能源角度考虑,可采用的解决方案是
。
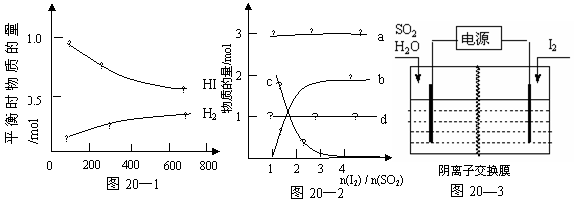
(3)碘化氢热分解反应为:2HI(g) H2(g) + I2(g),分解曲线如图20—1,分解反应平衡常数表达式为:K= ;升高温度时平衡常数K (选填:“增大”或“减小”)。
H2(g) + I2(g),分解曲线如图20—1,分解反应平衡常数表达式为:K= ;升高温度时平衡常数K (选填:“增大”或“减小”)。
(4)本生(Bunsen)反应中SO2和I2及H2O发生的反应为:SO2+I2+2H2O=3H++HSO4-+2I-,
I-+I2 I3-。
I3-。
①当起始时,SO2为1mol,水为16mol,溶液中各离子变化关系如图20—2,图中b变化表示的离子是 ;在水相中进行的本生反应必须使水和碘显著过量,但易
引起副反应将反应器堵塞等。写出浓硫酸与HI发生反应生成硫和碘的化学方程式
。
②野村(Nonura)等人提出利用电解的方法进行本生反应,反应原理如图20—3所示,则阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究元素及其化合物的反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+ O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如右图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:

①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
2SO3(g)的△H____0(填“>”、“<”)。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”) 。
②若温度为T1时,反应进行到状态D时,V正_______V逆(填“>”“<”或“=”)
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产中有重要作用。
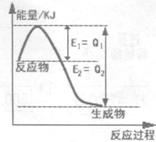
① 右图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式:(△H用含字母Q1、Q2的代数式表示) 。
②在AlCl3溶液中滴加氨水,反应的离子方程式为: 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25℃下,向0.1mol•L-1的NaCl溶液中逐滴加入适量的0.1mol•L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol•L-1的NaI溶液,看到的现象是 全品教学网, 用后离不了!,产生该现象的原因是(用离子方程式表示): 。
全品教学网, 用后离不了!(已知25℃时Ksp[AgCl] =1.0×10-10 mol2•L-2,Ksp[AgI] =1.5×10-16mol2•L-2 )
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究性学习小组利用下图中所列装置设计实验,证明浓硫酸和木炭粉在加热条件下反应有SO2和CO2生成。
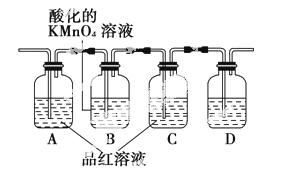
(1)实验时可观察到装置中A瓶溶液褪色,C瓶溶液不褪色。
A瓶溶液的作用是___________________________________,
B瓶溶液的作用是___________________________________,
C瓶溶液的作用是___________________________________。
(2)装置D中所盛溶液是________,可验证的产物是______。
(3)若想同时验证另一种产物的存在,需使用的药品为________,该装置在整套装置中的位置是________,理由是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )。
A.Fe与S混合加热生成FeS2
B.NaHCO3的热稳定性大于Na2CO3
C.过量的铜与浓硝酸反应有一氧化氮生成
D. 白磷在空气中加热到一定温度能转化为红磷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com