
【题目】实验室以废铜为原料制取碱式碳酸铜(Cu2(OH)2CO3)的过程如下:
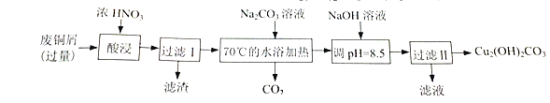
完成下列填空:
(1)酸浸中产生的气体是_________(填化学式)。
(2)检验过滤Ⅱ的沉淀是否洗净的方法是________。
(3)从实验流程中可看出影响产品生成的因素有多种,请写出其中两个:___________, 并任选其中一个因素,说明其原因___________。
(4)CuSO4溶液和纯碱溶液混合同样也可以制得Cu2(OH)2CO3,写出该反应的化学方程式:______。
(5)产品中Cu含量的测定步骤是:称取mg样品,用适量稀硫酸完全溶解,加水稀释,调节溶液为中性或弱酸性,再加入过量的KI-淀粉溶液后,用c mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液v mL。实验中反应的离子方程式为2Cu2++4I-→2CuI(白色)↓+I2;I2+2S2O32-→2I-+S4O62-。
(i)样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,其原因是________。
(ii)产品中Cu的含量为__________________(用含m、c、v的代数式表示)。
【答案】NO、NO2 取最后一次洗涤液测其pH,若溶液为中性,则沉淀已洗净 温度和pH(反应物浓度、反应物配比等合理答案也得分) 温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢(或:pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜)。 2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑ 若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2SO3溶液 0.064cv/m
【解析】
废铜屑溶于浓硝酸中转化为硝酸铜,过滤除去滤渣,向滤液中加入碳酸钠溶液,除去多余的硝酸,然后加入氢氧化钠溶液调节pH生成碱式碳酸铜,据此解答。
(1)酸浸中铜与浓硝酸反应生成二氧化氮(NO2),随着浓度的降低,会产生一氧化氮(NO),
故答案为:NO、NO2;
(2)根据流程分析可知,碱式碳酸铜是从含有碳酸钠的溶液中析出的,所以检验沉淀是否洗净就是检验沉淀上有没碳酸根离子,操作方法是取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净,
故答案为:取最后一次洗涤液滴加氯化钡溶液,若溶液中没有出现沉淀,则沉淀已洗净;
(3)从实验流程中可看出温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜,所以影响产品生成的因素有温度和pH,
故答案为:温度和pH;温度过高,碱式碳酸铜会分解生成氧化铜,温度过低,反应速率太慢,或:pH过低,得不到碱式碳酸铜,pH过高则生成氢氧化铜;
(4)CuSO4溶液和纯碱溶液混合同样也可以制得Cu2(OH)2CO3,根据元素守恒可知反应的化学方程式为2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑,
故答案为:2CuSO4+2Na2CO3+H2O→Cu2(OH)2CO3↓+2Na2SO4+CO2↑;
(5)①样品溶于稀硫酸后,需加水稀释,控制溶液为中性或弱酸性,若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2S2O3溶液,
故答案为:若溶液酸性过强,则2H++S2O32-→S↓+SO2+H2O,多消耗Na2SO3溶液;
②根据反应2Cu2++4I-→2CuI(白色)↓+I2、I2+2S2O32-→2I-+S4O62-可得关系式Cu2+~S2O32-,根据题意可知,Na2S2O3的物质的量为cv×10-3mol,所以样品中铜元素的质量为0.064cvg,进而确定产品中Cu的含量为0.064cv/m,
故答案为:0.064cv/m。


科目:高中化学 来源: 题型:
【题目】常温下,H3AsO4溶液中各含砷粒子分布分数(平衡时该粒子的浓度与各含砷粒子浓度之和的比)与pH的关系如右图所示。下列说法正确的是
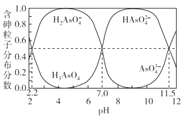
A. H3AsO4的第一步电离常数Ka1>0.01
B. pH=7.0时.溶液中c(AsO43-)=c(H3AsO4)=0
C. 0.1mol·L-1H3AsO4溶液的pH<2
D. pH=12时,c(H+)=3c(AsO43-)+2c(HAsO42-)+c(H2AsO4-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. 丙酸与甲酸甲酯互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图。下列对该实验的描述错误的是
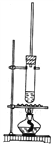
A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 为提纯乙酸丁酯,可用水和碳酸钠溶液洗涤
D. 通常加入过量1-丁醇以提高乙酸的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA
B.2.0 g H218O与D2O的混合物中所含中子数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.3 mol Fe在足量的水蒸气中完全反应转移9NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100 mol/L的盐酸和醋酸的混合液,电导率曲线如图所示。下列说法错误的是

A.①点溶液中c(H+)为0.200 mol/L
B.②点溶液中c(Cl-)>c(NH4+)>c(Ac-)
C.①点溶液中n(所有离子)之和>③点溶液n(所有离子)之和
D.③点后会出现pH=7的点,此点溶液中c(NH4+)=c(Ac-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬是一种解热、阵痛、消炎药,其药效强于阿司匹林。可通过以下路线合成:
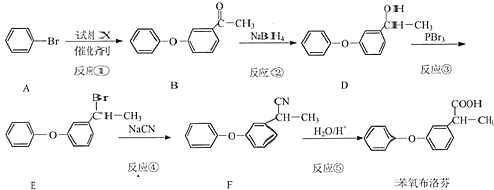
完成下列填空:
(1)反应①中加入试剂X的分子式为C8H8O2,X的结构简式为_______。
(2)反应①往往还需要加入KHCO3,加入KHCO3的目的是__________。
(3)在上述五步反应中,属于取代反应的是________(填序号)。
(4)B的一种同分异构体M满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。则M的结构简式: ____。
(5)请根据上述路线中的相关信息并结合已有知识,写出以![]() 、CH2CHO。为原料制备
、CH2CHO。为原料制备![]() 的合成路线流程图(无机试剂任用)____。
的合成路线流程图(无机试剂任用)____。
合成路线流程图示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据操作和现象所得出的结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向KI溶液中加入30%H2O2、稀硝酸及淀粉溶液,溶液变蓝 | H2O2氧化性比I2强 |
B | 向Na2CO3溶液中加稀硫酸将产生的气体通入硅酸钠溶液中产生白色沉淀 | 非金属性:S>C>Si |
C | 向某溶液中滴加稀NaOH溶液时,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液不含NH4+ |
D | 将BaSO4浸泡在饱和Na2CO3溶液中,一段时间后过滤并洗涤沉淀,向沉淀中加入稀盐酸,有气泡产生 | Ksp(BaSO4)>Ksp(BaCO3) |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com