
向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,溶液呈红色,则这种酸可能是()
A. pH=2的硫酸 B. 0.01 mol•L﹣1的甲酸
C. pH=2的醋酸 D. 0.01 mol•L﹣1的硝酸
考点: pH的简单计算.
专题: 电离平衡与溶液的pH专题.
分析: 向10mL pH=12的NaOH溶液中加入10mL某酸,再滴入几滴甲基橙,溶液呈红色,说明溶液呈酸性,反应后酸过量,以此解答该题.
解答: 解:A.加入10mL pH=2的硫酸,恰好反应生成硫酸钠,溶液呈中性,故A错误;
B.加入0.01 mol•L﹣1的甲酸,生成甲酸钠,为强碱弱酸盐,水解呈碱性,故B错误;
C.pH=2的醋酸浓度比pH=12的NaOH溶液大,反应后醋酸过量,溶液呈酸性,故C正确;
D.加入0.01 mol•L﹣1的硝酸,恰好反应生成硝酸钠,溶液呈中性,故D错误;
故选C.
点评: 本题考查酸碱混合的定性判断和计算,为2015届高考常见题型,题目难度中等,侧重于学生的分析能力和计算能力的考查,注意明确酸碱物质的量的关系的确定以及电解质强弱的判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下,下列叙述正确的是()
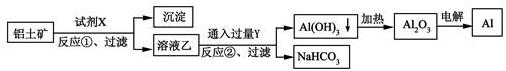
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①、过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
某含Na+的溶液中还可能含有NH4+、Fe3+、Br-、CO32-、I-、SO32-。取样,滴加足量氯水有气泡产生,溶液呈橙色;向橙色溶液中加Ba Cl2溶液或淀粉
Cl2溶液或淀粉
溶液均无现象。为确定该溶液的组成,还需进行的实验有 ( )
A.取样,滴加硫氰化钾溶液
B.取样,加氯水和CCl4,振荡、静置
C.取样,加足量盐酸加热,用湿润的品红试纸检验气体
D.取样,加足量的NaOH浓溶液,加热,用湿润的红色石蕊试纸检验气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是 ( )
A.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
B.Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH-
C.酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液在25℃时由水电离出氢离子的浓度为1×10﹣12 mol•L﹣1,下列说法正确的是()
A. 该溶液pH=12 B. 该溶液pH=2
C. 该溶液pH=12或2 D. 不能确定溶液pH
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,若体积为Va、pH=a的某一元强酸与体积Vb、pH=b的某一元强碱混合,恰好中和,且已知Va<Vb和a=0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”),其理由是;
(2)a值可否等于5(填“可”或“否”),其理由是,
(3)a的取值范围是.
查看答案和解析>>
科目:高中化学 来源: 题型:
1988年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化。下列说法正确的是( )
A.化学不再是纯实验化学
B.化学不再需要实验
C.化学不做实验,就什么都不知道
D.未来化学的方向还是经验化学
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z三种金属,把它们放在稀硫酸中,只有Y溶解放出气体。将Z放入X的盐溶液中,有X金属析出。已知X、Y、Z在化合物中均显+2价,则下列结论正确的是( )
A.金属性:Z>Y>X
B.还原性:X>Y>Z
C.氧化性:X2+>Z2+>Y2+
D.氧化性:X2+>Y2+>Z2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某醇在适当条件下与足量的乙酸发生酯化,得到的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,有关该醇应该具有的结构特点的描述正确的是()
A. 该醇分子中一定具有甲基
B. 该醇分子中一定没有甲基
C. 该醇分子中至少含有三个碳原子
D. 该醇分子中具有两个醇羟基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com