
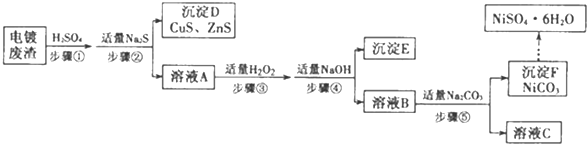
分析 废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质),用硫酸溶解,再向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤,滤液A中含有Ni2+、Fe2+、Cr3+,加热H2O2将Fe2+氧化成Fe3+,再通过调节pH值使Cr3+、Fe3+都以氢氧化物的沉淀而除去,滤液B含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠得NiCO3沉淀,过滤、洗涤,然后用硫酸溶解,再加热浓缩、冷却结晶、过滤、洗涤、干燥得到NiSO4晶体.
(1)充分搅拌,增大接触面积,提高反应速率;
(2)用硫酸酸化后的溶液中含有氢离子,再加入硫化钠溶液生成硫化氢;
(3)在酸性条件下,H2O2使Fe2+转化为Fe3+,同时生成水;过氧化氢不稳定,容易分解;
(4)氢氧化铁溶度积小于Cr(OH)3的溶度积,说明氢氧化铁更难溶,Cr3+沉淀完全时,Fe3+已经完全沉淀,根据Ksp[Cr(OH)3]≈1.0×10-32计算溶液中c(OH-),再根据水的离子积计算c(H+),根据pH=-lgc(H+);
(5)溶液C中溶质的主要成分是硫酸钠;
(6)Ni2+离子有有色,根据上层清液中颜色判断;
(7)过滤分离出NiCO3沉淀,再用硫酸溶解;
(8)降低溶解度,减少损失,有利于蒸发;
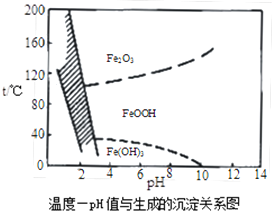
(9)a.FeOOH中铁为+3价;
b.pH=4时,反应中c(OH-)=10-10mol/L,再根据Ksp[Fe(OH)3]≈2.64×10-39计算溶液中c(Fe3+);
c.ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应,结合电荷守恒、原子守恒与电子转移守恒判断;
d.由图可知,工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8.
解答 解:废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质),用硫酸溶解,再向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤,滤液A中含有Ni2+、Fe2+、Cr3+,加热H2O2将Fe2+氧化成Fe3+,再通过调节pH值使Cr3+、Fe3+都以氢氧化物的沉淀而除去,滤液B含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠得NiCO3沉淀,过滤、洗涤,然后用硫酸溶解,再加热浓缩、冷却结晶、过滤、洗涤、干燥得到NiSO4晶体.
(1)步骤①中加入H2SO4后,需充分搅拌,增大接触面积,加快反应速率、提高浸出率,
故答案为:加快反应速率、提高浸出率;
(2)用硫酸酸化后的溶液中含有氢离子,再加入硫化钠溶液生成硫化氢,反应离子方程式为:2H++S2-=H2S↑,
故答案为:2H++S2-=H2S↑;
(3)H2O2使Fe2+转化为Fe3+的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,保持温度在40℃左右的原因是:减少过氧化氢的分解,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;减少过氧化氢的分解;
(4)氢氧化铁溶度积小于Cr(OH)3的溶度积,说明氢氧化铁更难溶,Cr3+沉淀完全时,Fe3+已经完全沉淀,根据Ksp[Cr(OH)3]≈1.0×10-32,可知溶液中c(OH-)=$\root{3}{\frac{1.0×1{0}^{-32}}{{10}^{-5}}}$=1.0×10-9,则c(H+)=1.0×10-5,pH=-lg1.0×10-5=5,
故答案为:5;
(5)溶液C中溶质的主要成分是Na2SO4,
故答案为:Na2SO4;
(6)Ni2+离子有有色,碳酸镍已完全沉淀的简单方法是:上层清液呈无色,
故答案为:上层清液呈无色;
(7)步骤⑥:过滤,洗涤碳酸镍,
步骤⑦:用硫酸溶解碳酸镍,
故答案为:过滤,洗涤碳酸镍;用硫酸溶解碳酸镍;
(8)用乙醇洗涤的优点是:降低溶解度,减少损失,有利于干燥,
故答案为:降低溶解度,减少损失,有利于干燥;
(9)a.FeOOH中铁为+3价,故a错误;
b.pH=4时,反应中c(OH-)=10-10mol/L,根据Ksp[Fe(OH)3]≈2.64×10-39,可知溶液中c(Fe3+)=$\frac{2.64×1{0}^{-39}}{(1{0}^{-10})^{3}}$mol/L=2.64×10-9mol/L,故b错误;
c.ClO3-在酸性条件下具有强氧化性,与Fe2+发生氧化还原反应,配平方程式为:6Fe2++ClO3-+6H+═6Fe3++Cl-+3H2O,故c正确;
d.由图可知,工业生产中温度常保持在85~95℃生成黄铁矾钠,此时水体的pH约为1.2~1.8,故d正确,
故选:cd.
点评 本题考查物质制备工艺流程、物质分离提纯的实验方案的设计,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| A. | Li2NH中N的化合价是-1 | B. | 该反应中H2既是氧化剂又是还原剂 | ||
| C. | H-的离子半径比Li+大 | D. | 此法储氢和钢瓶储氢的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5项 | B. | 4项 | C. | 3项 | D. | 2项 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH4(g)+2O2(g)→CO2(g)+2H2O(g)+Q1 CH4(g)+$\frac{3}{2}$O2(g)→CO(g)+2H2O(g)+Q2 | |
| B. | S(s)+O2(g)→SO2(g)+Q1 S(g)+O2(g)→SO2(g)+Q2 | |
| C. | H2(g)+Br2(g)→2HBr(q)+Q1 H2(g)+Cl2(g)→2HCl(q)+Q2 | |
| D. | HCl(aq)+NaOH(aq)→NaCl(aq)+H2O(l)+Q1 CH3COOH(aq)+NaOH(aq)→CH3COONa(aq)+H2O(l)+Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(HB-)+2c(H2B)=c(OH-) | B. | c(Na+)+c(OH-)=c(H+)+c(HB-) | ||
| C. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | D. | 2c(B2-)+2c(HB-)=0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com