
| A. | 1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 | |
| B. | 在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| C. | 在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 | |
| D. | 常温若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的pH=11 |
分析 A.酸溶液的pH不可能大于7;
B.根据弱电解质的电离平衡来分析稀释后的pH;
C.根据离子对氨水的电离平衡的影响来分析平衡移动及溶液的pH;
D.根据酸碱混合及溶液的pH=7来分析NaOH溶液的pH.
解答 解:A.酸溶液的pH一定小于7,则盐酸溶液的pH不会为8,故A错误;
B.因醋酸是弱电解质,稀释时促进电离,但氢离子的浓度减小,则pH变大,即b>a,故B错误;
C.在氨水中存在电离平衡,当加入NH4Cl,平衡逆向移动,氢氧根离子的浓度减小,由酚酞的变色范围8.2~10可知,此时溶液的pH可能小于8.2,不一定小于7,故C错误;
D.因酸碱混合后pH=7,即恰好完全反应,设碱的浓度为c,则1×0.1mol/L=100×c,c=0.001mol/L,则NaOH溶液的pH=11,故D正确;
故选D.
点评 本题考查了电离平衡及pH的有关计算,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,学生应注意酸的溶液的pH在常温下一定小于7,利用影响平衡的因素及酸碱反应的实质来分析解答即可.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 27 g铝原子最外层电子总数为NA | |
| B. | 2.8 g N2和2.8 g NO2所含电子数均为1.4NA | |
| C. | 1 L 0.1 mol•L-1乙酸溶液中H+数为0.1NA | |
| D. | 标准状况下,22.4 L甲烷的分子数NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,乙为
,乙为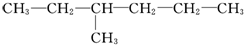 .下列有关它们命名的说法正确的是( )
.下列有关它们命名的说法正确的是( )| A. | 甲、乙的主链碳原子数都是6个 | B. | 甲、乙的主链碳原子数都是5个 | ||
| C. | 甲的名称为2-丙基-1-丁烯 | D. | 乙的名称为3-甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
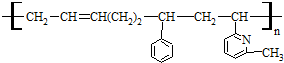
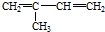
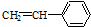
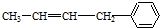
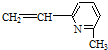
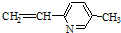
| A. | ②③⑥ | B. | ①②⑥ | C. | ②③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和盐酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
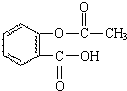 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com