
 .
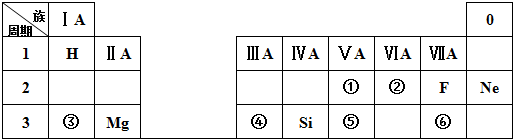
. 分析 由与元素在周期表中的位置可知①~⑥分别为N、O、Na、Al、P、Cl等,
(1)⑤位于第三周期第ⅤA族,是P元素;
(2)根据元素在周期表中的位置可以确定①⑤分别为N、P,同主族自上而下原子半径逐渐增大;
(3)③位于第三周期第ⅠA族,是Na元素,其最高价氧化物对应的水化物为NaOH,④位于第三周期第ⅢA族,是Al元素,其最高价氧化物对应的水化物为Al(OH)3,氢氧化铝具有两性,可与氢氧化钠反应生成偏铝酸钠;
(4)根据元素在周期表中的位置可以确定③⑥分别为Na、Cl,形成的化合物是离子化合物NaCl.
解答 解:由与元素在周期表中的位置可知①~⑥分别为N、O、Na、Al、P、Cl等,
(1)位于第三周期第ⅤA族,是P元素,故答案为:P;
(2)①位于第二周期第ⅤA族,是N元素,⑤位于第三周期第ⅤA族,是P元素,同主族自上而下原子半径逐渐增大,原子半径:P>N,因此原子半径较大的是P,
故答案为:P;
(3)③位于第三周期第ⅠA族,是Na元素,其最高价氧化物对应的水化物为NaOH,④位于第三周期第ⅢA族,是Al元素,其最高价氧化物对应的水化物为Al(OH)3,Al(OH)3与NaOH反应的化学方程式为:Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(4)③位于第三周期第ⅠA族,是Na元素,⑥位于第三周期第ⅦA族,是Cl元素,形成的化合物是离子化合物NaCl,电子式为: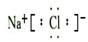
故答案为: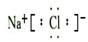 .
.
点评 本题考查元素周期表的结构和元素周期律综合应用,为高频考点,侧重于学生的分析能力的考查,通过元素在周期表中的位置确定是何种元素是解题的关键,试题比较基础,难度中等.


科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
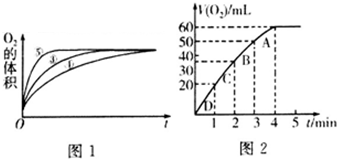
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ;
; 、和
、和 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .请回答:
.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率与逆反应速率相等 | B. | 正反应速率与逆反应速率均为零 | ||
| C. | 反应物和生成物浓度相等 | D. | 反应停止了 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
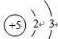 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
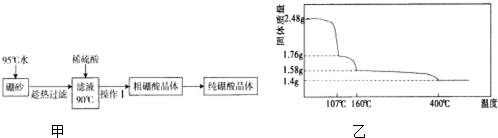
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
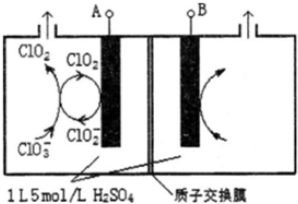 研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.
研究含Cl、N、S等元素的化合物对净化水质、防治污染有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 | 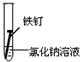 | 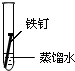 | 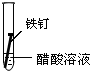 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是重要的化工原料,用途很广.
氨是重要的化工原料,用途很广.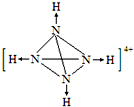 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com